આંશિક દબાણ અને બાષ્પ દબાણ વચ્ચે તફાવત
આંશિક દબાણ અને વરાળનો દબાણ સામાન્ય રીતે ઉપયોગમાં લેવાય છે સિસ્ટમના ઘટકો દ્વારા મુકાયેલા દબાણની સંખ્યાને લગતી વૈજ્ઞાનિક શરતો, પરંતુ તેમની ઓળખ અન્ય લોકો માટે ગૂંચવણભરી હોઇ શકે છે. તેમની શરતો અને ઓળખ સહિત આ શબ્દો વચ્ચે સ્પષ્ટ ભેદ છે. આ લેખ આ શરતોમાંના તફાવતો પર વધુ વિસ્તૃત કરશે. તેમાં તેના કેટલાક કાર્યક્રમોનો નિર્મિત કરવાના કેટલાક ઉદાહરણો પણ શામેલ છે.
વરાળ અને આંશિક દબાણ વચ્ચે ભેદ પાડવામાં આવે તે પહેલાં દબાણના ખ્યાલને હાઈલાઈટ કરીને શરૂ કરીએ. પદાર્થને અથવા પદાર્થ પર પ્રતિ એકમ વિસ્તારને લાગુ પાડીને દબાણ તરીકે વૈજ્ઞાનિક રીતે વ્યાખ્યા કરવામાં આવે છે. તે એકબીજા પર ટકરાતા કણો દ્વારા લાગુ બળ તરીકે પણ વ્યાખ્યાયિત કરી શકાય છે અને તે ઘણીવાર પાસ્કલ દ્વારા માપવામાં આવે છે. કણોની અથડામણના કિસ્સામાં, ગેસ સમીકરણ અને ગેસનું ગતિ સિદ્ધાંતનો ઉપયોગ દબાણની ગણતરી કરવા માટે થાય છે.
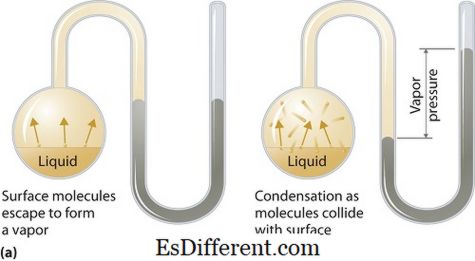
બાષ્પ દબાણ શું છે?
બાષ્પનું દબાણ પ્રવાહી અથવા નક્કર તબક્કાઓ માટે અરજી કરી શકે છે. વરાળ અને પ્રવાહી (ઘન) બંને સંપર્કમાં હોય ત્યારે બંધ સિસ્ટમમાં આપેલ તાપમાને તેની પ્રવાહી અથવા નક્કર સ્થિતિ પર તેના ઉષ્મીય ધારાશાસ્ત્રમાં બાષ્પ દ્વારા દબાણ કરવામાં આવે છે. બાષ્પીભવનના પરિણામે આ દબાણ ઊભું થાય છે, જે ઘન અથવા પ્રવાહી પર વધેલા ગરમીથી સક્રિય થાય છે. આમ તાપમાન બાષ્પીભવનના માપ તરીકે વપરાય છે અને તે બાષ્પ દબાણના સીધા પ્રમાણમાં છે. આનો અર્થ એ થાય કે ઊંચા તાપમાને ઊંચા વરાળનું દબાણ છે.
બાષ્પીભવન દરમિયાન, હવાના અણુઓ એક બંધ પ્રણાલીમાં ઊંચી ગતિશીલ ઊર્જાના પરિણામે ભાગી જાય છે. પછી જ્યારે સંતુલનમાં હોય ત્યારે વરાળ અને તેના પ્રવાહી (ઘન) ના કન્ડેન્સ્ડ સ્વરૂપ વચ્ચે વરાળનું દબાણ ઊભું થાય છે. આંતર-મૌખિક દળો નબળા હોય તેવા ઉકેલોમાં, વરાળનું દબાણ વધુ હોઇ શકે છે, અને ઊલટું, જ્યાં આંતર-મૌખિક દળો મજબૂત છે, વરાળનું દબાણ ઓછું છે.
રૌલ્ટના કાયદા દ્વારા વર્ણવવામાં આવેલું આદર્શ મિશ્રણમાં વરાળનું દબાણ પણ થઇ શકે છે. તે જણાવે છે કે પ્રવાહી અથવા નક્કર મિશ્રણમાં ચોક્કસ ઘટકનું આંશિક વરાળનું દબાણ તે ઘટકના બાષ્પ દબાણને સમકક્ષ હોય છે જે તેના મોલના અપૂર્ણાંક દ્વારા ચોક્કસ તાપમાને તે મિશ્રણ દ્વારા ગુણાકાર કરે છે. નીચેના ઉદાહરણમાં તે સમજાશે.
ઉદાહરણ 1.
0 નું આદર્શ મિશ્રણ જોયું. 5 મોલ. ઇથેનોલ અને 1. 5 મોલ. અનુક્રમે 30 કેપીએ અને 52 કેપીએના બાષ્પ દબાણ સાથે મેથેનોલ, દરેક ઘટકનું આંશિક વરાળ દબાણ નક્કી કરે છે.
સોલ્યુશન:
મોલ્સની કુલ સંખ્યા 1 છે. 5 મીલ +0. 5 મીલ = 2. 0 મીલ. રાઉલ્ટના કાયદા અનુસાર, આંશિક વરાળનો દબાણ એ ચોક્કસ ઘટકના દાઢ અપૂર્ણાંક દ્વારા ગુણાકારના વરાળના દબાણને સમાન છે.આ કિસ્સામાં, પી મેથેનોલ = 1. 5/2 * 52 = 39 કેપીએ અને પી ઇથેનોલ = 0. 5/2 * 30 = 7. 5 કેપીએ.
જ્યારે મિશ્રણમાં ઘટકોના આંશિક બાષ્પ દબાણ હોય, ત્યારે તમે તેમને એકસાથે ઉમેરીને કુલ બાષ્પ દબાણ મેળવી શકો છો. આ સંબંધમાં, 7. 5 + 39 46 આપે છે. 5 કેપીએ ઇથેનોલ અને મિથેનોલ ઉકેલોના મિશ્રણનું કુલ બાષ્પ દબાણ.
વરાળના દબાણને અસર કરતાં પરિબળો
અણુની ઓળખ
જેમ ઉપર જણાવેલું છે તેમ, મોલેક્યુલર દળોના પ્રકારોનો ઉપયોગ વરાળના દબાણના જથ્થાને નિર્ધારિત કરે છે. જો દળો મજબૂત હોય તો, ઓછા વરાળનો દબાણ ઉભો થાય છે, અને નબળા હોય તો વધુ વરાળનું દબાણ ઊભું થાય છે. તેથી, પ્રવાહી અથવા ઘનની રચના વરાળના દબાણને અસર કરશે.
તાપમાન
ઊંચા તાપમાને ઊંચા વરાળના દબાણ તરફ દોરી જાય છે કારણ કે તે પરમાણુ દળોને તોડવા માટે વધુ ગતિશીલ ઊર્જા સક્રિય કરે છે જેથી અણુઓ પ્રવાહી સપાટીથી ઝડપથી છીનવી શકે. બાષ્પ દબાણ (સંતૃપ્ત વરાળ દબાણ) બાહ્ય દબાણ (વાતાવરણીય દબાણ) ની સમકક્ષ હોય ત્યારે પ્રવાહી ઉકળવા શરૂ કરશે. નીચું તાપમાન નીચા વરાળના દબાણ સાથે પરિણમશે અને તે પ્રવાહીને ઉકળવા માટે સમય લેશે.

ડાલ્ટનનો આંશિક દબાણનો કાયદો
આંશિક દબાણ શું છે?
જાણીતા વૈજ્ઞાનિક જ્હોન ડાલ્ટન દ્વારા આંશિક દબાણનો વિચાર સૌપ્રથમ પ્રસ્તાવિત હતો. તે તેના આંશિક દબાણના કાયદાને જન્મ આપ્યો છે જેમાં જણાવાયું છે કે ગેસના આદર્શ મિશ્રણ દ્વારા ઉત્પન્ન કરવામાં આવેલા કુલ દબાણ વ્યક્તિગત ગેસના આંશિક દબાણના સરવાળા જેટલું છે. કહો કે કોઈ ચોક્કસ કન્ટેનર હાઇડ્રોજન, નાઇટ્રોજન અને ઓક્સિજન વાયુઓથી ભરવામાં આવે છે, કુલ દબાણ, પી કુલ, ઑકિસજન, નાઇટ્રોજન અને હાઇડ્રોજનના સરવાળા જેટલું હશે. તે મિશ્રણમાં કોઇ પણ ગેસનું આંશિક દબાણ વ્યક્તિગત ગેસના દાઢ અપૂર્ણાંક દ્વારા કુલ દબાણને ગુણાકાર દ્વારા ગણવામાં આવે છે.
ટૂંકમાં, આંશિક દબાણ એ મિશ્રણમાં ચોક્કસ ગેસ દ્વારા દબાણ કરવામાં આવે છે જેમ કે તે સિસ્ટમમાં એકલા કાર્યરત છે. વ્યક્તિગત ગેસનો આંશિક દબાણ નક્કી કરતી વખતે તમે અન્ય ગેસને અવગણી શકો છો. આ સિદ્ધાંતને ઇન્જેક્શન દ્વારા કહેવામાં આવે છે, 0.10 મીટરના ઓએ 2 એક.0 માં 0 લિ કન્ટેનર અને પછી ઇન્જેકશન 0. 4atm N 2 એક સમાન કન્ટેનરમાં સમાન તાપમાને સમાન કદના, અને પછી આખરે કુલ દબાણ માપવા માટે ગેસને ભેગા કરો; તે બે ગેસનો સરવાળો હશે. આ સ્પષ્ટ રીતે બિન-પ્રતિક્રિયાશીલ વાયુઓના મિશ્રણમાં વ્યક્તિગત ગેસનો આંશિક દબાણ સમજાવે છે.
અંશતઃ દબાણની ગણતરી કરવી
ડાલ્ટનના કાયદા [1] થી આંશિક દબાણની ગણતરી કરવા માટે ચોક્કસ ગોઠવણ છે જે તે માટે જોગવાઈઓ આપે છે. તે પ્રદાન કરેલ લાક્ષણિક માહિતી પર આધારિત હશે. ઉદાહરણ તરીકે, ઉદાહરણ તરીકે, ગેસ એ અને બીના મિશ્રણ માટે અને ગેસ A ના દબાણ માટે કુલ દબાણ આપવામાં આવે છે, તો બીનો આંશિક દબાણ P TOTAL = P નો ઉપયોગ કરીને ગણવામાં આવે છે. એ + પી બી . બાકીના બીજગણિત મેનિપ્યુલેશન્સ છે. પરંતુ એવા કિસ્સામાં જ્યાં મિશ્રણનું કુલ દબાણ આપવામાં આવ્યું છે, તે નક્કી કરવા માટે તમે ગેસ બીના દળ અપૂર્ણાંકનો ઉપયોગ કરી શકો છો આંશિક દબાણ.ગ્રોઅર અપૂર્ણાંક, X દ્વારા સૂચિત, ગેસ મિશ્રણના કુલ મોલ્સ દ્વારા ગેસ બીના મોલને વિભાજન કરીને મળી શકે છે. પછી આંશિક દબાણ શોધવા માટે, તમે કુલ દબાણ દ્વારા મોલર અપૂર્ણાંક, એક્સ ને ગુણાકાર કરો છો. નીચે આપેલા ઉદાહરણમાં દર્શાવવામાં આવ્યું છે કે
ઉદાહરણ 2.
નાઈટ્રોજન અને ઓક્સિજનનો મિશ્રણ, 2. 5 મોલ્સ અને 1. અનુક્રમે 85 મોલ્સ, 20 માં ઇન્જેક્ટ થાય છે. ઓક્સિજન ગેસ દ્વારા ઉત્પન્ન થયેલા આંશિક દબાણની ગણતરી કરો.
સોલ્યુશન:
મિશ્રણમાં કુલ મોલ્સ 2 છે. 5 + 1. 85 = 4. 35 મોલ્સ. તેથી ઓક્સિજન, X o ના દળ અપૂર્ણાંક, 1. 85 moles / 4 હશે. 35 મોલ્સ = 0. 425 મોલ્સ. ઓક્સિજનનો આંશિક દબાણ 0 હશે. 425 * 4 ટીએમ = 1. 7 કરો. બાકીના ગેસના આંશિક દબાણને એ જ અભિગમને અનુસરીને ગણતરી કરી શકાય છે અથવા ઓક્સિજન ગેસ અને ડાલ્ટનના આંશિક દબાણના કાયદા દ્વારા વિસ્તૃત કરાયેલા કુલ દબાણનો ઉપયોગ કરીને ગણતરી કરી શકાય છે કે બિન-પ્રતિક્રિયાશીલ વાયુઓના કુલ દબાણનો સરવાળો બરાબર છે આંશિક દબાણો
વરાળ અને અંશતઃ દબાણ વચ્ચે તફાવત
ઉપરના સ્પષ્ટતાથી, તે સ્પષ્ટ છે કે વરાળનું દબાણ અને અંશતઃ દબાણ બે અલગ દબાણ છે. બાષ્પ દબાણ પ્રવાહી અને ઘન તબક્કાઓ પર લાગુ પડે છે, જ્યારે આંશિક દબાણ વાયુ તબક્કા પર લાગુ પડે છે. બંધ પધ્ધતિમાં બચવા માટે તેના અણુઓ તરફ દોરીને ઉકેલ માટે પૂરતી ગરમી ઉમેરી દેવામાં આવે તે પછી તબક્કાના સંક્રમણમાં બાષ્પ દબાણ કરવામાં આવે છે.
આંશિક દબાણ અને વરાળના દબાણ વચ્ચેનું મુખ્ય તફાવત એ છે કે આંશિક દબાણ એ એક વ્યક્તિગત ગેસ દ્વારા મિશ્રણમાં લાદવામાં આવતું દબાણ છે, જેમ કે તે તે સિસ્ટમમાં એકલા હોય છે, જ્યારે વરાળનો દબાણ તેના વરાળથી લાદવામાં આવેલા દબાણને દર્શાવે છે પ્રવાહી અથવા નક્કર ઘટ્ટ રાજ્ય સાથે થર્મોડાયનેમિક સંતુલન નીચે કોષ્ટક આ દબાણોનો સંક્ષિપ્ત સરખામણી દર્શાવે છે.
| વરાળ પ્રેશર | આંશિક દબાણ |
| તે પ્રવાહી અથવા ઘન બાષ્પ દ્વારા સંતુલનમાં તેના કન્ડેન્સ્ડ તબક્કા પર આવે છે | તે બિન-પ્રતિક્રિયાશીલ ગેસ મિશ્રણમાં વ્યક્તિગત ગેસ દ્વારા ઉપયોગમાં લેવામાં આવે છે |
| રૌલ્ટના કાયદો | વેલને ડાલ્ટનના કાયદા દ્વારા સમજાવી |
| ઘન અને પ્રવાહી તબક્કાઓમાં લાગુ પડે છે | ગેસિયસ તબક્કાઓમાં જ લાગુ પડે છે |
| સપાટીના વિસ્તાર અથવા સિસ્ટમના કદનો સ્વતંત્ર | ગેસનો ઉપયોગ કરીને ગણતરી કરવામાં આવે છે વોલ્યુમ |
| સોલ્યુટના મોલ અપૂર્ણાંકનો ઉપયોગ કરીને ગણતરી કરો | ગેસના મોલ અપૂર્ણાંકનો ઉપયોગ કરીને ગણતરી કરો |
ઉપર લપેટી!
બાષ્પ દબાણ અને આંશિક દબાણ એ બે મહત્વના વૈજ્ઞાનિક શબ્દો છે જે ચોક્કસ તાપમાને આપેલ બંધ સિસ્ટમમાં અનુક્રમે વરાળ અને વાયુઓ દ્વારા લાગુ કરાયેલી દળોની અસરો નક્કી કરવા માટે વપરાય છે. તેમનો મુખ્ય તફાવત પ્રવાહી અથવા ઘન તબક્કાઓ પર લાગુ વરાળ દબાણ સાથેની એપ્લીકેશન વિસ્તાર છે, જ્યારે આપેલ વોલ્યુમમાં આદર્શ ગેસના મિશ્રણમાં વ્યક્તિગત ગેસ પર આંશિક દબાણ લાગુ પડે છે.
ડાલ્ટનના આંશિક દબાણના પગલે આંશિક દબાણ સરળતાથી ગણવામાં આવે છે, જ્યારે વરાળનું દબાણ રાઉલ્ટના કાયદા દ્વારા લાગુ કરવામાં આવે છે.કોઈપણ મિશ્રણમાં, દરેક ગેસ ઘટક તેના પોતાના દબાણને અસર કરે છે, જેને અન્ય વાયુઓથી સ્વતંત્ર આંશિક દબાણ કહેવાય છે. અને જ્યારે તમે કોઈ પણ ઘટકના મોલ્સને બરોબર સતત રહેશો, ત્યારે તમે તેના આંશિક દબાણમાં વધારો કરશો. ક્લાઉસિયસ-ક્લાપેયરન સંબંધ [2] મુજબ, વરાળનો દબાણ તાપમાન વધે છે.
ઉપરોક્ત માહિતી સાથે, તમારે વરાળ દબાણ અને અંશતઃ દબાણ વચ્ચે તફાવત હોવા જોઈએ. તમે મોલ્લર અપૂર્ણાંકનો ઉપયોગ કરીને અને કુલ દબાણ દ્વારા ગુણાકાર કરવા માટે સક્ષમ હોવા જોઈએ. આ દબાણોના અમલ પર વિસ્તૃત કરવા માટે અમે તમને વિશિષ્ટ ઉદાહરણો આપ્યા છે.




