સિગ્મા અને પીઆઇ બોન્ડ વચ્ચે તફાવત.
સિગ્મા બોન્ડ શું છે?
સિગ્મા બોંડ અણુઓના બંધ મધ્યવર્તી ભાગને જોડતી ધરી સાથે રચાયેલા અણુઓમાં અણુઓ વચ્ચેના બોન્ડ્સ છે.
મોલેક્યુલર બોન્ડ્સ
અણુ રસાયણ બંધન દ્વારા ઇલેક્ટ્રોનનું વિનિમય કે વહેંચો ત્યારે રચે છે. ત્યાં ત્રણ પ્રકારના બોન્ડ્સ આવશ્યક છે આયનીય બોન્ડ્સ, મેટાલિક બોન્ડ્સ અને સહસંયોજક બંધ. આયનીય બોન્ડ્સમાં, અણુઓ ફક્ત એક ઇલેક્ટ્રોનનું વિનિમય કરશે જેથી એક પરમાણુ હકારાત્મક રીતે ચાર્જ થશે અને અન્ય નકારાત્મક રીતે ચાર્જ થશે, જેના કારણે તેમને ઇલેક્ટ્રોમેગ્નેટિક બળ દ્વારા ખેંચવામાં આવે છે. મેટાલિક બોન્ડ્સમાં, ઇલેક્ટ્રોન એકસરખી રીતે સમગ્ર અણુ દ્વારા વિતરણ કરવામાં આવશે, જે મુક્ત, ડેલૉકલાઇઝ્ડ ઇલેક્ટ્રોનનો ઇલેક્ટ્રોન બનાવશે જે ઇલેક્ટ્રોન તરફ આકર્ષાય તેવા હકારાત્મક આયોજનો ફેલાવશે.
સહકારના બોન્ડ્સમાં ઇલેક્ટ્રોન વહેંચાયેલું છે અને જે રીતે તે વહેંચાયેલું છે તે ઇલેક્ટ્રોનની સંભાવના વાદળો, અને ઓર્બિટલ્સ જેમાં તેઓ સ્થિત છે, તે રીતે સપ્રમાણ છે તે રીતે ઓવરલેપ કરવું.
ઓર્બિટલ્સ અને સિગ્મા બોન્ડ્સ
ઓર્બિટલ્સ ચોક્કસ ઉર્જા સ્તરો સાથે સંકળાયેલા અણુઓના વિસ્તારો છે. ન્યુક્લિયસથી દૂર ઓરબિટલ્સના ઇલેક્ટ્રોનમાં ઇલેક્ટ્રોન કરતાં વધુ ઊર્જા ઓક્યુએલયલ્સની નજીક ઓર્બિટલ્સમાં હશે. જ્યારે એક અણુની ઓર્બિટેલ્સ બીજા અણુથી ઓર્બિટેલ્સ સાથે ઓવરલેપ થાય છે, ત્યારે તેઓ મોલેક્યુલર ઓર્બિટલ્સ બનાવે છે જે મોલેક્યુલર બોન્ડ માટે પરવાનગી આપે છે, જે અલબત્ત, પરમાણુઓ માટે પરવાનગી આપે છે.
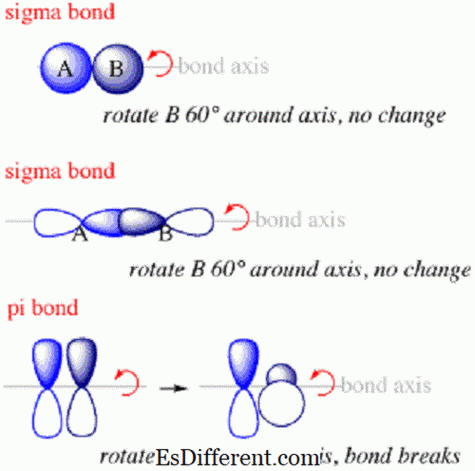
સિગ્મા બોન્ડ એ પ્રથમ પ્રકારનું બોન્ડ છે જે અણુ વચ્ચે રચાય છે. સિગ્મા બોન્ડની અંદર, ઇલેક્ટ્રોન સંભાવના વાદળો બંધિત અણુઓના મધ્યવર્તી કેન્દ્રને જોડતી ધરી સાથે હશે. સિગ્મા બોન્ડ ખાસ કરીને જ્યારે s વિવિધ અણુથી ઓર્બિટેલ્સ બોન્ડ બનાવવા માટે ઓવરલેપ કરશે ત્યારે રચના કરશે. તેઓ હંમેશાં બે મધ્યવર્તી ભાગો વચ્ચેના ધરી પર રચના કરશે કારણ કે s ભ્રમણ કક્ષીય ભ્રમણકક્ષા જેવા કંઇક ગોઠવણ કરે છે.
સિગ્મા બોન્ડ્સ અને સિગ્મા ઓર્બિટલ્સ
સિગ્મા બોન્ડ બનાવતા ઇલેક્ટ્રોન સિગ્મા ઓર્બિટલ્સની અંદર હશે અને આમ બાયોડ્ડ અણુના મધ્યભાગમાં જોડાયેલા ધરી સાથે ક્યાંક હશે. જોકે સિગ્મા બોન્ડ, સ્થિર અથવા અસ્થિર હોઈ શકે છે, તેના આધારે તે ઇલેક્ટ્રોન સિગ્મા બોન્ડીંગ ઓર્બિટલ અથવા એન્ટી-બોન્ડીંગ ઓર્બિટલમાં છે.
સિગ્મા બંધન ઓર્બિટલ્સ એ મધ્યવર્તી કેન્દ્ર વચ્ચેના અવકાશમાં હશે, જ્યારે વિરોધી-બંધનની ઓર્બિટલ્સ એ અણુ સાથે જોડાયેલ ધરી સાથે હશે, પરંતુ તેમની વચ્ચેની જગ્યાની વિરુદ્ધની અણુઓની બાજુઓ પર હશે. સિગ્મા બોન્ડ સ્થિર થશે જો વધુ ઇલેક્ટ્રોન બોન્ડીંગ ઓર્બીટલ્સમાં હોય અને અસ્થિરતા વધુ હોય તો એન્ટિબંડિંગ ઓર્બિટલ્સમાં હોય અથવા જો બંનેમાં સમાન ઇલેક્ટ્રોન હોય.
પી બાંદ શું છે?
પાઇ બોન્ડ અણુઓમાં અણુ વચ્ચેના બોન્ડ છે જ્યાં ઇલેક્ટ્રોન જોડાયેલ અણુના મધ્યભાગમાં જોડાયેલ ધરીથી ઉપર અને નીચે છે, પરંતુ અક્ષ સાથે નહીં.તેઓ બીજા પ્રકારના બોન્ડ છે જે સિગ્મા બોન્ડ પછી એક પરમાણુમાં રચના કરશે.
પાઇ બૉન્ડ્સ અને p ઓર્બીટેલ્સ
પીઓ બોન્ડ્સ બોન્ડિંગ ધરીથી ઉપર અને નીચે બનાવે છે, પરંતુ તે સાથે નથી કારણ કે તેઓ સામાન્ય રીતે ઓર્બ્રેટેબલ ઓરબીટલ્સ જેમ કે p બંધિત અણુઓ પર ઓર્બિટેલ્સ. આ ઓર્બિટલ્સમાં બીજક પર ઇલેક્ટ્રોન ડેન્સિટી નથી. પરિણામે, ઓવરલેપિંગ p ઓર્બિટલ્સથી બનેલા પાઇ બૉન્ડ્સનું ઇલેક્ટ્રોન હંમેશા એવા પ્રદેશમાં ક્લસ્ટર કરશે જે અસ્થાયી સીધી અડીને નથી. પાઇ બોન્ડ અન્ય અણુ ઓર્બિટલ્સ વચ્ચે પણ રચના કરી શકે છે, જેમ કે d ઓર્બિટલ્સ જેમાં સામાન્ય લક્ષણો ધરાવે છે p ઓર્બીટેલ્સ
પાઇ બૉન્ડ્સ અને પી ઓર્બિટલ્સ
ક્યારે પૃષ્ઠ વિવિધ અણુઓના ઓર્બિટલ્સ ઓવરલેપ કરે છે, તેઓ મોલેક્યુલર પી ઓર્બિટલ્સ બનાવે છે જે ફોર્મ માટે પીઆઇ બોન્ડ્સ માટે પરવાનગી આપે છે. ઇલેક્ટ્રોન સ્થિત થયેલ ભ્રમણકક્ષામાં તેના આધારે બોન્ડ ફરી એકવાર સ્થિર અથવા અસ્થિર બની શકે છે. પીઆઇ બોન્ડ ઓર્બિટલ્સમાં વધુ ઇલેક્ટ્રોન હોય તો પાઇ બોન્ડ સ્થિર રહેશે. વિરોધી બોન્ડીંગ ઓર્બીટલ્સમાં વધુ હોય અથવા જો સમાન સંખ્યા બન્નેમાં હોય તો તે અસ્થિર હશે.
સિગ્મા બોન્ડ્સ અને પી બૉન્ડ્સ વચ્ચે સમાનતા
સિગ્મા બોન્ડ્સ અને પીઓ બૉન્ડ બંને ચોક્કસ મોલેક્યુલર ઓર્બિટલ્સ પર આધારિત છે, જે ચોક્કસ અણુ ઓર્બિટલ્સના ઓવરલેપિંગથી ઉતરી આવ્યા છે, ઉદાહરણ તરીકે, s કેસમાં ઓર્બિટેલ્સ સિગ્મા બોન્ડ્સ અને p પી બાંધોના કિસ્સામાં ઓર્બિટેલ્સ. ઇલેક્ટ્રોન બોન્ડિંગ મોલેક્યુલર ઓર્બિટલ્સ અથવા એન્ટિ-બોન્ડીંગ મોલેક્યુલર ઓર્બિટલ્સમાં છે તેના આધારે તેઓ સ્થિર અથવા અસ્થિર હોઈ શકે છે.
સિગ્મા બોન્ડ્સ અને પી બૉન્ડ્સ વચ્ચેના તફાવતો
તેમની સમાનતા હોવા છતાં, મહત્વપૂર્ણ તફાવત છે
- સિગ્મા બોન્ડ બનાવતા ઇલેક્ટ્રોન એ જોડાયેલ ન્યુક્લીવને જોડતી ધરી સાથે જગ્યામાં વિતરણ કરવામાં આવશે જ્યારે પીઆઇ બોન્ડ્સ અંદરના ઇલેક્ટ્રોનને ધરીની ઉપર અને નીચે વહેંચવામાં આવશે પરંતુ તેની સાથે નહીં.
- સિગ્મા બોન્ડ અણુઓમાં અણુ વચ્ચે રચના કરવા માટેના પ્રથમ બોન્ડ છે જ્યારે પી બીઓન્ડ બીજા છે.
- સિગ્મા બોન્ડ્સ ઘણીવાર s વિવિધ અણુઓમાં ઓર્બિટલ્સના મિશ્રણ દ્વારા રચાય છે, જ્યારે પાઇ બોન્ડ્સ p અને વિવિધ અણુમાં સમાન ઓર્બિટલ્સના મિશ્રણમાંથી બને છે.
- વધુમાં, ઓવરલેપિંગ ઑર્બીટેલ્સ કે જે પાઇ બૉન્ડ્સ બનાવે છે તેની દિશામાં ઓવરલેપિંગ ઑર્બીટેલ્સ કે જે સિગ્મા બોન્ડ્સ બનાવે છે તે લંબરૂપ હશે.
સિગ્મા બોન્ડ વિ. પાઇ બોન્ડ્સ
| સિગ્મા બોન્ડ | પાઇ બોન્ડ |
| પરમાણુ ઓર્બિટલ્સ બોન્ડિંગ અસી સાથે ઓવરલેપ | અણુ ઓર્બિટલ્સ બોન્ડિંગ અસી ઉપર અને નીચે ઓવરલેપ |
| અણુઓમાં અણુ વચ્ચે રચના કરવા માટે પ્રથમ બોન્ડ | અણુઓમાં અણુઓ વચ્ચે રચના કરવા માટે બીજા બોન્ડ્સ |
| ઓવરલેપિંગ ઓર્બિટલ્સ જેમ કે s ઓર્બીટેલ્સ | ઓવરલેપિંગ ઑર્બીટેલ્સ જેવા કે p ઑર્બીટેલ્સ |
| ઓવરલેપિંગ ઑર્બીટેલ્સ સિગ્મા અને પી બૉન્ડ્સ | સિગ્મા બોન્ડ એ અણુના અણુ વચ્ચેનું બંધન છે જે ઘણી વખત |
s < જોડાયેલી મધ્યવર્તી કેન્દ્રને જોડતી ધરી સાથે ઓવરબૅપ કરતા ઓર્બિટેલ્સતે રચના કરવા માટે સૌપ્રથમ છે અને તેની સ્થિરતા એ સિગ્મા બંધન અને એન્ટિબૉન્ડીંગ ઑર્બીટેલ્સમાં કેવી રીતે ઇલેક્ટ્રોન વહેંચવામાં આવે છે તે પર આધાર રાખે છે. પાઇ બોન્ડ્સ અલ્ટોલિંગ
p વિવિધ અણુથી ઓર્બિટલ્સથી વારંવાર રચાયેલા પરમાણું બોન્ડ્સ છે. પાઇ બૉન્ડ બનાવતા ઇલેક્ટ્રોનને બોન્ડ એટોમના મધ્યભાગમાં જોડાયેલા ધરીથી ઉપર અને નીચે, પરંતુ ધરી સાથે નહીં વહેંચવામાં આવશે. આ બોન્ડ્સની સ્થિરતા પણ બંધન અને એન્ટીબૉન્ડિંગ પી ઓર્બિટલ્સ પર આધારિત છે. સિગ્મા બોન્ડ અણુઓમાં રચના કરવા માટે પ્રથમ બોન્ડ હશે, જ્યારે પીઓ બોન્ડ ફોર્મમાં બીજા બોન્ડ હશે. પિ બોન્ડ્સ અણુ ઓર્બિટલ્સથી પણ રચાય છે, જે સિગ્મા બોન્ડ્સ બનાવવા માટે લંબરૂપ છે.



