કોમ્બિનેશન અને ડિસમમ્પશન રિએક્શન વચ્ચે તફાવત. કોમ્બિનેશન વિ વિઘટન પ્રતિક્રિયા
કી તફાવત - કોમ્બિનેશન વિસર્જન પ્રતિક્રિયા પ્રતિક્રિયા
એક રાસાયણિક પ્રતિક્રિયા એક અથવા વધુ રાસાયણિક સંયોજનોનું એક અથવા વધુ રૂપાંતરણ છે વિવિધ પ્રોડક્ટ્સ, રાસાયણિક સંયોજનની ઓળખ બદલીને. રાસાયણિક પ્રતિક્રિયાના પ્રારંભિક સામગ્રીને પ્રતિક્રિયા કહેવામાં આવે છે અને પરિણામી સંયોજનને ઉત્પાદન કહેવાય છે. સંયોજનોના મિશ્રણ અથવા સંયોજનોના સંયોજન અને નવા સંયોજનોનું નિર્માણ રાસાયણિક પ્રતિક્રિયા પ્રક્રિયા દરમિયાન થાય છે કારણ કે સંયોજનના અણુઓ વચ્ચેના બોન્ડ ભાંગી અને જુદી રીતે બનાવવામાં આવે છે. રાસાયણિક પ્રતિક્રિયાઓને ઘણી વ્યાપક શ્રેણીઓમાં વહેંચી શકાય છે. રેડોક્સ પ્રતિક્રિયાઓ અથવા ઓક્સિડેશન-ઘટાડાની પ્રતિક્રિયાઓ તેમની વચ્ચે ખૂબ મહત્વપૂર્ણ છે. ઓક્સિડેશન અને ઘટાડાની પ્રતિક્રિયાઓને ઇલેક્ટ્રોન ટ્રાન્સફર પ્રતિક્રિયાઓ કહેવામાં આવે છે કારણ કે પ્રતિક્રિયાઓનું નિર્માણ કરવા માટે રિએક્ટન્ટ્સના ઇલેક્ટ્રોન એક સંયોજનમાંથી બીજામાં ટ્રાન્સફર થાય છે. રેડોક્સ પ્રતિક્રિયામાં, બે સમાંતર પ્રતિક્રિયાઓ, જેને અર્ધ-પ્રતિક્રિયા કહેવામાં આવે છે તે જ સમયે થાય છે. આ અડધા પ્રતિક્રિયાઓ ઇલેક્ટ્રોન ટ્રાન્સફર દર્શાવે છે. આ અડધા પ્રતિક્રિયાઓને સંતુલિત કરીને, એક અંતમાં જે થયું તે એકંદર પ્રતિક્રિયાનો અંદાજ કાઢે છે. કોમ્બિનેશન પ્રતિક્રિયાઓ અને વિઘટન પ્રતિક્રિયાઓ બે મુખ્ય પ્રકારના રેડોક્સ પ્રતિક્રિયાઓ છે. મિશ્રણ અને વિઘટન પ્રતિક્રિયા વચ્ચેનું મુખ્ય તફાવત એ છે કે સંયોજન પ્રતિક્રિયામાં એક પ્રોડક્ટ આપવા માટે પ્રતિક્રિયાઓના મિશ્રણનો સમાવેશ થાય છે જ્યારે વિઘટન પ્રતિક્રિયામાં એક જ સંયોજનના બે અથવા વધુ ઉત્પાદનોમાં વિરામનો સમાવેશ થાય છે.
વિષયવસ્તુ
1 ઝાંખી અને કી તફાવત
2 કોમ્બિનેશન રિએક્શન
3 શું છે ડિસમપોશન રિએક્શન
4 શું છે સાઇડ બાય સાઇડરિસન - કોમ્બિનેશન વિ ડિસેમ્પોશન રિએક્શન
5 સારાંશ
કોમ્બિનેશન રિએક્શન શું છે?
એક સંયોજન પ્રતિક્રિયા, જેને સંશ્લેષણ પ્રતિક્રિયા [999] તરીકે પણ ઓળખવામાં આવે છે, એ પ્રતિક્રિયા છે, જેમાં પ્રણાલિક સંયોજનોને ઉત્પાદન તરીકે એક અલગ સંયોજન રચવા માટે જોડવામાં આવે છે. અન્ય શબ્દોમાં, સરળ અણુઓની પ્રતિક્રિયા એક જટિલ પરમાણુમાં પરિણમે છે. તે ચોક્કસ સંયોજનના અણુઓ વચ્ચેના કેટલાક અથવા બધા બોન્ડ તૂટી ગયાં છે; તે જ સમયે, પરમાણુ નવા સંયોજનને બનાવશે, જે ઉત્પાદન છે. વિઘટન પ્રતિક્રિયાઓમાં, સમાન પ્રતિક્રિયાઓ બંને અડધા પ્રતિક્રિયાઓ માટે પ્રારંભિક સામગ્રી તરીકે કામ કરે છે.વિઘટન પ્રતિક્રિયાઓથી વિપરીત, સંયોજન પ્રતિક્રિયાઓના અડધા પ્રતિક્રિયાઓ સાથે અલગ રીએક્ટન્ટ્સ શરૂ થાય છે. એક પ્રોડક્ટમાં કોમ્બિનેશન પ્રતિક્રિયા પરિણામો. નીચેના એક સામાન્ય ઉદાહરણ છે જે દહન પ્રતિક્રિયાઓ તરીકે આપી શકાય છે.
2 ) માં આવે છે ત્યારે મિશ્રણ પ્રતિક્રિયા થાય છે અને એલ્યુમિનિયમ બ્રૉમાઇડ (આલ્બર્ટ 3 ) ઉત્પન્ન કરે છે. અહીં, ઓક્સિડેશન નંબર અલમાં વધારો અને BR માં ઘટાડો થયો છે. તેથી, તે રેડોક્સ પ્રતિક્રિયા છે અને મિશ્રણ પ્રતિક્રિયા છે કારણ કે બે પ્રતિક્રિયાઓએ એક ખાસ ઉત્પાદન આપવા માટે પ્રતિક્રિયા આપી છે. આકૃતિ 01: કોમ્બિનેશન રીએક્શન
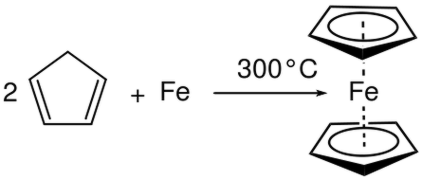
રેડોક્સ પ્રતિક્રિયાઓની શ્રેણીમાં વિઘટન પ્રતિક્રિયા એક વધુ મહત્વપૂર્ણ પ્રતિક્રિયા છે. તે મૂળભૂત મિશ્રણ પ્રતિક્રિયાના વિરોધાભાસી છે. એક વિઘટન પ્રતિક્રિયા એ પ્રતિક્રિયા છે જ્યાં પ્રતિક્રિયા સંયોજન ઉત્પાદનોમાં ભાંગી પડે છે. અહીં, અર્ધ-પ્રતિક્રિયાઓ ઓક્સિડેશન પ્રતિક્રિયા અને ઘટાડો પ્રતિક્રિયા જેવી જ સમયે થાય છે. પરંતુ સંયોજન પ્રતિક્રિયામાં વિપરીત, બન્ને અડધા પ્રતિક્રિયાઓ માટેના પ્રતિક્રિયા એ વિઘટન પ્રતિક્રિયામાં સમાન છે. વિઘટન પ્રતિક્રિયા ઘણા ઉત્પાદનોમાં પરિણમે છે.
પાણીનું વિદ્યુત વિચ્છેદન, જ્યારે સીધી વર્તમાન પાણીમાંથી પસાર થાય છે ત્યારે, પાણીના અણુને ઓક્સિજન અને હાઇડ્રોજન ગેસ આપવા માટે ઊતરે છે. અહીં, ઓક્સિડેશન નંબર ઓક્સિજન અણુમાં વધારો થાય છે અને હાઇડ્રોજન અણુમાં ઘટાડો થાય છે. આથી, તે રેડોક્સ પ્રતિક્રિયા છે અને ઓક્સિજન અને હાઇડ્રોજન ગેસમાં પાણીના અણુઓના વિરામના કારણે વિઘટન પ્રતિક્રિયા છે.
આકૃતિ 02: કોમ્બિનેશન વિ ડિકેમ્પ્શન

કોમ્બિનેશન એન્ડ ડીકમશન રીએક્શનમાં શું તફાવત છે?
કોષ્ટક ->
મિશ્રણ વિઘટન પ્રત્યાઘાતો
સંયોજન પ્રતિક્રિયાઓમાં બે અથવા વધુ પ્રતિક્રિયાશીલ સંયોજનો સામેલ છે. |
|
| વિઘટન પ્રતિક્રિયામાં એક સંયોજન સામેલ છે. | પ્રોડક્ટ્સ |
| એકલ પ્રોડક્ટમાં કોમ્બિનેશન પ્રતિક્રિયા પરિણામો | |
| વિઘટન પ્રતિક્રિયાઓ ઘણા ઉત્પાદનોમાં પરિણમે છે | અર્ધ પ્રતિક્રિયાઓ |
| સંયોજન પ્રતિક્રિયાઓમાં, બે અડધા પ્રતિક્રિયાઓમાં બે અલગ અલગ શરુ અણુઓ છે. | |
| વિઘટન પ્રતિક્રિયાઓમાં, એક પરમાણુ બંને અડધા પ્રતિક્રિયાઓ માટે પ્રારંભિક સામગ્રી તરીકે કાર્ય કરે છે. | કેમિકલ બોન્ડ્સ |
| કોમ્બિનેશન પ્રતિક્રિયાઓ એક ઓવરને અંતે ઉત્પાદન પેદા કરવા માટે અણુઓ બંધન પરિણમે. | |
| વિઘટન પ્રતિક્રિયાઓમાં, બે કે તેથી વધુ અંત ઉત્પાદનો બનાવવા માટે રાસાયણિક બોન્ડ્સ ભાંગી પડે છે. | મોલેક્યુલિસ |
| કોમ્બિનેશન પ્રતિક્રિયાઓ પરમાણુ પરમાણુઓ પ્રતિક્રિયા કરવા અને ઉત્પન્ન કરવા માટે સરળ અણુ પેદા કરે છે. | |
| વિઘટન પ્રતિક્રિયાઓને કારણે સરળ અણુઓમાં સરળ અણુઓમાં તૂટી જાય છે. | સારાંશ - કોમ્બિનેશન વિ ડિયોમ્પોઝિશન રીએક્શન |
રેડોક્સ પ્રતિક્રિયાઓ ખૂબ જ અગત્યનો ભાગ છે, કારણ કે અગત્યની રાસાયણિક પ્રતિક્રિયાઓ રેડોક્સ પ્રતિક્રિયાઓ છે. કોમ્બિનેશન પ્રતિક્રિયાઓ અને વિઘટન પ્રતિક્રિયાઓ સરળ પ્રતિક્રિયાઓ છે જે એકબીજાથી વિરુદ્ધ છે. મિશ્રણ અને વિઘટન પ્રતિક્રિયા વચ્ચેનું મુખ્ય તફાવત એ છે કે મિશ્રણ પ્રતિક્રિયામાં એક કે અંતિમ ઉત્પાદનમાં પરિણમે બે અથવા વધુ પ્રોસેંટન્ટ અણુના સંયોજનનો સમાવેશ થાય છે જ્યારે વિઘટન પ્રતિક્રિયામાં એક અથવા બેથી વધુ ઉત્પાદનોમાં એક પરમાણુનું વિરામનો સમાવેશ થાય છે.
સંદર્ભો:
1. ચાંગ, આર., 2010. રસાયણશાસ્ત્ર 10 મી આવૃત્તિ. ન્યૂ યોર્ક: મેકગ્રો-હિલ
2 રેડોક્સ. (2009, 30 જુલાઈ) // weakinteractions માંથી મે 29, 2017, પુનઃપ્રાપ્ત. WordPress કોમ / પ્રાઇમર્સ / રેડોક્સ /
3 પ્રતિક્રિયાઓ (એનડી.) સુધારો મે 29, 2017, // www રિક edu / faculty / ptiskus / પ્રતિક્રિયાઓ /
છબી સૌજન્ય:
1. બર્ટ દ્વારા "મિલર ફેરોસેન સિનથેસે" કિલોનોસ્કી - પોતાના કામ (CC0) કૉમન્સ મારફતે વિકિમિડિયા
2 "રાસાયણિક પ્રતિક્રિયાઓ" ડેનિયલ પુગ્લીજી દ્વારા - પોતાના કામ (સીસી-બીએ-એસએ 3. 0) કોમન્સ દ્વારા વિકિમિડિયા [કાપલી]


