હાઈડ્રોલીસિસ અને કન્ડેન્સેશન વચ્ચેના તફાવત
હાયડ્રોલીસિસ વિ કંડેન્સેશન
સંકોચન અને હાયોડલીસિસ બે પ્રકારના રાસાયણિક પ્રતિક્રિયાઓ છે, જે બોન્ડ રચના અને બોન્ડ બ્રેપેજમાં સામેલ છે. સંકોચન એ હાઇડ્રોલીસિસનું રિવર્સ છે આ બે પ્રકારની પ્રતિક્રિયાઓ સામાન્ય રીતે જૈવિક પ્રણાલીઓમાં જોવા મળે છે, અને અમે આ પ્રતિક્રિયાઓનો ઉપયોગ ઘણી વ્યાપારી રીતે મહત્વપૂર્ણ ઉત્પાદનો મેળવવા માટે કરીએ છીએ.
ઘનીકરણ
સંકોચન પ્રતિક્રિયાઓ એક પ્રકારનું રાસાયણિક પ્રતિક્રિયા છે જ્યાં નાના અણુઓ એકસાથે મોટા એક પરમાણુ રચવા માટે ભેગા થાય છે. પ્રતિક્રિયા પરમાણુઓમાં બે કાર્યાત્મક જૂથોમાં થાય છે. ઘનીકરણ પ્રતિક્રિયાના અન્ય લાક્ષણિકતા એ છે કે પ્રતિક્રિયા દરમિયાન નાના પરમાણુ ગુમાવ્યો છે. આ પરમાણુ પાણી, હાઇડ્રોજન ક્લોરાઇડ, એસિટિક એસિડ વગેરે હોઇ શકે છે. જો હવામાં અણુ પાણી હોય તો તે પ્રકારના ઘનીકરણની પ્રતિક્રિયાઓ ડીહાઈડરેશન પ્રતિક્રિયાઓ તરીકે ઓળખાય છે. પ્રતિક્રિયાના અણુઓ નાના હોય છે અને ઉત્પાદનનું અણુ ખૂબ મોટું હોય છે, ઉત્પાદનોની ઘનતા ઘનીકરણની પ્રતિક્રિયાઓમાં પ્રતિક્રિયાઓ કરતા હંમેશા વધારે હોય છે. સંકોચન પ્રક્રિયા ઘણી રીતે થાય છે. ઉદાહરણ તરીકે, અમે આને બે પ્રકારોમાં વિભાજીત કરી શકીએ છીએ જેમ કે ઇન્ટરમોોલિક્યુલર કન્ડેન્સેશન પ્રતિક્રિયાઓ અને ઇન્ટ્રા-મોલેક્યુલર કોન્સેન્સેશન પ્રતિક્રિયાઓ. જો બે વિધેયાત્મક જૂથો એ જ અણુમાં રહે છે, તો તેઓ ઇન્ટ્રા-મોલેક્યુલર કંડેન્સેશન તરીકે ઓળખાય છે. ઉદાહરણ તરીકે, નીચે પ્રમાણે ગ્લુકોઝનું રેખીય માળખું છે.
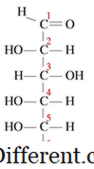
ઉકેલમાં મોટાભાગના પરમાણુઓ ચક્રીય માળખામાં છે. ચક્રીય માળખું રચે છે ત્યારે, કાર્બન 5 પર ઓએચ (H) કાર્બનની સાથે રિંગ બંધ કરવા માટે, ઈથર લિન્ગેજમાં રૂપાંતરિત થાય છે. આ છ સભ્યોનું હેમીસેટલ રિંગ માળખું બનાવે છે. આ ઇન્ટ્રા-મોલેક્યુલર કોન્સેન્સેશન પ્રતિક્રિયા દરમિયાન, પાણીના અણુને બગાડવામાં આવે છે, અને ઈથર લિન્ગેજ રચાય છે. ઇન્ટરમોોલિક્યુલર પ્રતિક્રિયાઓ ઘણા ઉપયોગી અને સામાન્ય ઉત્પાદનો ઉત્પન્ન કરે છે. આ દરમિયાન, પ્રતિક્રિયા બે જુદા અણુઓના કાર્યકારી જૂથો વચ્ચે થાય છે. દાખલા તરીકે, જ્યારે પ્રોટીન જેવી મેક્રોમોલેક્લ્યુલર બનાવતી વખતે એમિનો એસિડ કન્ડેન્સ્ડ થાય છે. પાણીનું અણુ છોડવામાં આવે છે, અને એક એમીડાઈડ લિન્ગેજ રચાય છે જે પેપ્ટાઇડ બોન્ડ તરીકે ઓળખાય છે. જયારે બે એમિનો એસિડ એકસાથે બંધાયેલા હોય છે ત્યારે એક ડાયપેપ્ટેઇડ રચાય છે, અને જ્યારે ઘણા એમીનો એસિડ જોડાય છે ત્યારે તેને પોલિપીપ્ટાઇડ કહેવાય છે. ડીએનએ અને આરએનએ ન્યુક્લિયોટાઇડ્સ વચ્ચેના ઘનીકરણની પ્રતિક્રિયાઓના પરિણામે રચના કરાયેલા બે અણુશક્તિ છે. ઘનીકરણની પ્રતિક્રિયાઓ મોટા પ્રમાણમાં પરમાણુ ઉત્પન્ન કરે છે અને ક્યારેક પરમાણુઓ તેટલા મોટા નથી. ઉદાહરણ તરીકે: આલ્કોહોલ અને કાર્બોક્સિલેક એસિડ વચ્ચેના એસ્ટરિફિકેશન પ્રતિક્રિયામાં, એક નાના એસ્ટરનું અણુ રચાય છે. પોલિમર રચનામાં ઘનીકરણ મહત્વનું છે. પોલિમર મોટા અણુઓ છે, જે એક જ માળખાકીય એકમ ઉપર અને ઉપર પુનરાવર્તિત હોય છે.પુનરાવર્તન એકમોને મોનોમર્સ કહેવામાં આવે છે. આ મૉનોમર્સ એકબીજા સાથે બંધારણીય બોન્ડ સાથે જોડાયેલા હોય છે જેથી પોલિમર રચાય.
હાઈડ્રોલીસિસ
આ એક પ્રતિક્રિયા છે જ્યાં પાણીના અણુનો ઉપયોગ કરીને રાસાયણિક બોન્ડ તૂટી જાય છે. આ પ્રતિક્રિયા દરમિયાન, પાણીનું પરમાણુ પ્રોટોન અને હાઇડ્રોક્સાઇડ આયનમાં વિભાજીત થાય છે. અને પછી આ બે આયન અણુના બે ભાગમાં ઉમેરવામાં આવે છે જ્યાં બોન્ડ તૂટી જાય છે. ઉદાહરણ તરીકે, નીચે એસ્ટર છે એસ્ટર બોન્ડ -કોઈ અને -ઓ વચ્ચે છે

જડ્રોલીસીસમાં, પાણીમાંથી પ્રોટોન એક બાજુ ઉમેરે છે, અને હાઈડ્રોક્સાઇડ આયન -કોના બાજુમાં ઉમેરે છે. તેથી, હાઇડ્રોલીસિસના પરિણામ સ્વરૂપે, ઍસ્ટર અને કાર્બોક્ઝિલિક એસિડ રચાય છે, જે એસ્ટરની રચના કરતી વખતે રિએક્ટન્ટ્સ હતા.
|
હાઇડ્રોસિસ અને કંડેન્સેશન વચ્ચે શું તફાવત છે? • હાઈડ્રોલીસિસ એ ઘનીકરણનું વિપરીત છે • ઘનીકરણ પ્રતિક્રિયાઓ રાસાયણિક બોન્ડ્સ બનાવે છે, જ્યારે હાઈડોલીસીસ રાસાયણિક બોન્ડને તોડે છે. • પોલીમર્સ ઘનીકરણ પ્રતિક્રિયાઓ દ્વારા બનાવવામાં આવે છે, અને તેઓ હાઇડોલીસિસ પ્રતિક્રિયાઓ દ્વારા તૂટી જાય છે. • ઘનીકરણ પ્રતિક્રિયાઓ દરમિયાન પાણીના અણુને છોડાવી શકાય છે. હાયોડલીસીસ પ્રતિક્રિયાઓમાં, પાણીનું અણુ પરમાણુમાં સામેલ કરવામાં આવ્યું છે. |



