ભૌમિતિક ઇસ્મોમર્સ અને માળખાકીય ઇસ્મોમર્સ વચ્ચેનો તફાવત
ભૌમિતિક ઇસ્મામર્સ વિ સ્ટ્રક્ચરલ ઇસ્મોમર્સ
આઇસોમોર્સ એક જ પરમાણુ સૂત્ર સાથે અલગ અલગ સંયોજનો છે. વિવિધ પ્રકારના આઇસોમર છે. Isomers મુખ્યત્વે બંધારણીય areomers અને stereoisomers તરીકે બે જૂથો વિભાજિત કરી શકાય છે. બંધારણીય ઇસ્મોમર્સ આઇઓમર્સ છે જ્યાં પરમાણુઓની કનેક્ટિવિટી પરમાણુઓમાં અલગ પડે છે. સ્ટિરીયોઇઝમર્સ અણુઓમાં સમાન અનુક્રમમાં જોડાયેલ છે, જે બંધારણીય ઇસ્મામરથી વિપરીત છે. સ્ટીરીયોઈઝોમર્સ જગ્યા પરના અણુઓની વ્યવસ્થામાં માત્ર અલગ છે. સ્ટિઅરિઓસોમર્સ બે પ્રકારની, એન્એન્ટીયોમર્સ અને ડાયટાસ્ટ્રૉમર્સ હોઇ શકે છે. ડાયાસ્ટ્રિઓરોમરો સ્ટીરિઓઓસોમર્સ છે, જેના પરમાણુઓ એકબીજાના ચિત્રોને મિરર નથી કરતા. એન્એન્ટીયોમર્સ સ્ટીરીયોઇઝમર્સ છે, જેના અણુ એકબીજાના નસસુપરપોર્પોબલ મિરર ઈમેજો છે. એન્એન્ટીયોમર્સ ચીરલ પરમાણુઓ સાથે જ જોવા મળે છે. એક ચીરલ પરમાણુને તે વ્યાખ્યાયિત કરવામાં આવે છે જે તેની મિરર ઇમેજ સાથે સમાન નથી. એના પરિણામ રૂપે, chiral પરમાણુ અને તેની મિરર છબી એકબીજાના enantiomers છે. ઉદાહરણ તરીકે, 2-બ્યુટેનોલ અણુ ચીરલ છે, અને તે અને તેની મિરર ઈમેટો એન્એન્થીયોમર્સ છે.
ભૌમિતિક ઇસ્મોમર્સ
ભૌમિતિક ઇસ્મામર્સ એક પ્રકારનો સ્ટીરિઓઓસોમર્સ છે. આ પ્રકારના આઇસોમર પરિણામો, જ્યારે પરમાણુઓ પ્રતિબંધિત પરિભ્રમણ ધરાવે છે, મૂળભૂત રીતે, ડબલ બોન્ડને કારણે. એક કાર્બન-કાર્બન બોન્ડ હોય ત્યારે, રોટેશન શક્ય છે. તેથી, જો કે અમે અણુઓ દોરીએ છીએ, તેમની વ્યવસ્થા એ સમાન હશે. પરંતુ જ્યારે કાર્બન-કાર્બન ડબલ બોન્ડ હોય છે, ત્યારે આપણે અણુમાં અણુઓની બે વ્યવસ્થાઓ બનાવી શકીએ છીએ. પરિણામી અણિયારાઓને સીઆઇએસ, ટ્રાન્સ ઇઝમર્સ અથવા ઇ-ઝેડ આઇસોમર્સ તરીકે ઓળખવામાં આવે છે. સીઆઇએસ આઇસોમરમાં, સમાન પ્રકારના અણુ એ પરમાણુની એક જ બાજુમાં હોય છે. પરંતુ ટ્રાન્સ આઇસોમરમાં, અણુના સમાન પ્રકારનાં અણુઓની વિરુદ્ધ બાજુ છે. ઉદાહરણ તરીકે, 1, 2-ડીક્લોરોએથેન માટે સીઆઇએસ અને ટ્રાન્સ માળખા નીચે મુજબ છે.
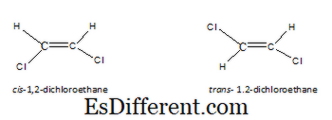
અણુમાં ભૌમિતિક ઇસ્માઓમ હોય તે માટે, તે ફક્ત ડબલ બોન્ડ જ પૂરતું નથી. બે અણુ અથવા બેવડા બોન્ડના એક ભાગ સાથે સંકળાયેલા જૂથો જુદા હોવા જોઈએ. ઉદાહરણ તરીકે, નીચેના અણુમાં ભૌમિતિક આયોજક નથી, બન્ને બાજુ પરના અણુઓ હાઈડ્રોજન છે. તે કારણે, જો આપણે તેને સીઆઈએસ અથવા ટ્રાન્સમાં દોરીએ તો, બંને પરમાણુઓ સમાન જ છે.

પરંતુ જો ચાર જુનવાળું જૂથો અથવા અણુ જુદાં જુદાં હોય તો તેમાં કોઈ વાંધો નથી. તે પ્રસંગે, અમે તેમને ઇ અથવા ઝેડ તરીકે નામ આપી શકીએ છીએ.
માળખાકીય ઇસ્મોમર્સ
આને બંધારણીય ઇસ્મોમર તરીકે પણ ઓળખવામાં આવે છે. બંધારણીય ઇસ્મોમર્સ આઇઓમર્સ છે, જ્યાં પરમાણુઓની કનેક્ટિવિટી પરમાણુઓમાં અલગ પડે છે. બ્યુટેન એ બંધારણીય આઇસોમેરિઝમને બતાવવા માટે સૌથી સહેલો છે. બૂટેને બે બંધારણીય આયોજક છે, બ્યુટેન પોતે અને આઇસોબ્યુટેન.

તેમની સંયોજનો અલગ હોવાને કારણે, બે અણુના વિવિધ ભૌતિક અને રાસાયણિક ગુણધર્મો હોય છે.હાઈડ્રોકાર્બન્સ દ્વારા માળખાકીય ઇસ્મોમર્સની રચના કરી શકાય છે, જ્યાં ઓછામાં ઓછા ચાર કાર્બન પરમાણુ હોય છે. કંકાલ, સ્થાયી અને વિધેયાત્મક ગ્રુપ આઇસોમર તરીકે ત્રણ પ્રકારના માળખાકીય ઇસ્મામર્સ છે. ઉપરના ઉદાહરણમાં આપેલું હાડપિંજર આઇસોમેરિઝમ છે, જુદા જુદા isomers આપવા માટે કંકાલ ફરીથી ગોઠવવામાં આવે છે. પોઝિશન આઇસોમર્સમાં, એક વિધેયાત્મક જૂથ અથવા અન્ય જૂથ પોઝિશન બદલે છે. વિધેયાત્મક ગ્રુપ આઇસોમર્સમાં, તેમ છતાં તે એક જ સૂત્ર ધરાવે છે, અણુ જુદા જુદા વિધેયાત્મક જૂથો ધરાવતાં હોય છે.
|
ભૌમિતિક ઇસ્મોમર્સ અને માળખાકીય ઇસ્મોમર્સ વચ્ચે શું તફાવત છે? • ભૌમિતિક ઇસ્મામર્સ સ્ટીરીયોઇઝમર્સ છે. તેથી, માળખાકીય ઇસ્મામર્સની તુલનામાં ત્યાં સંયોજનો પણ સમાન હોય છે, જ્યાં પરમાણુના સંયોજનોને કારણે અસ્થાયી અલગ પડે છે. ભૌમિતિક આયોજકમાં, તે જગ્યામાં ત્રણ પરિમાણીય વ્યવસ્થાને કારણે અલગ પડે છે. • મોટેભાગે અણુ માટે સીઝ, ટ્રાન્સ અથવા ઇ, ઝેડ તરીકે બે ભૌમિતિક ઇસોયોમર્સ છે, પરંતુ એક પરમાણુ માટે મોટી સંખ્યામાં માળખાકીય આયોજક હોઇ શકે છે. • ભૌમિતિક ઇસોયોમરિઝમ મૂળભૂત રીતે કાર્બન-કાર્બન ડબલ બોન્ડ્સ સાથે અણુ દ્વારા બતાવવામાં આવે છે. માળખાકીય isomerism alkanes, alkenes, alkynes અને સુગંધિત સંયોજનો, તેમજ દ્વારા બતાવવામાં આવે છે. |



