આલ્કલીઅલિટી અને મૂળભૂતતા વચ્ચેનો તફાવત | આલ્કલાઇનિટી વિ મૂળભૂતતા
કી તફાવત - અલ્કલીનીટી વિ. બેનિસીટી
બે શરતો "આલ્કલાઇન" અને "મૂળભૂત" બહુ ગૂંચવણમાં મૂકે છે. મોટાભાગના લોકો જાણે છે કે આ બે પરિમાણો વચ્ચેનો તફાવત છે, પરંતુ તેમાંના થોડા જ તેને યોગ્ય રીતે વ્યાખ્યાયિત કરવા સક્ષમ છે. કી તફાવત આ બે શબ્દો વચ્ચે તેમની વ્યાખ્યાઓમાં શ્રેષ્ઠ રીતે સમજાવવામાં આવે છે. મૂળભૂતતા એક માપ છે જે સીધા પીએચ સ્કેલ પર આધાર રાખે છે અને ક્ષારત્વ એ છે કે પીએચને નોંધપાત્ર એસિડ મૂલ્યમાં ઘટાડવા માટે કેટલી એસિડની જરૂર છે ; તેને એક જળ મંડળીની બફર ક્ષમતા [999] તરીકે પણ ઓળખવામાં આવે છે. અન્ય શબ્દોમાં, મૂળભૂત ઉકેલોની પીએચ કિંમત 7-14 થી અલગ અલગ છે; જ્યાં ઉચ્ચ પીએચ મૂલ્યોવાળા ઉકેલો વધુ મૂળભૂત છે બંનેમાં ઘણી વ્યાખ્યાઓ છે, પરંતુ સામાન્ય વિચાર સમાન છે.
આલ્કલાઇનિટી શું છે?એલ્કલેનિટી એ
જલીય શરીરમાં સૌથી મહત્વપૂર્ણ પરિમાણો પૈકીનું એક છે, અને જળચર સજીવો માટે તે ખૂબ જરૂરી છે આલ્કલાઇનથી એસિડ અને પાયા તટસ્થ કરવા માટે જળ સંસ્થાઓની ક્ષમતાને માપે છે. બીજા શબ્દોમાં કહીએ તો, તે પીએચ મૂલ્યને ખૂબ સ્થિર મૂલ્ય જાળવવા માટે પાણીના બફરીની ક્ષમતા છે. બાયકાર્બોનેટ (HCO 3 - ), કાર્બોનેટ (CO 3 2- ) અને હાઈડ્રોક્સાઇડ્સ (ઓએચ - ) એક પાણીનો બફરો છે; તેઓ પાણીના એચ + આયનો સાથે પાણીના પીએચ (વધુ મૂળભૂત બને છે) વધારવા માટે ભેગા થઈ શકે છે. જ્યારે ક્ષારત્વ ખૂબ ઓછું હોય (બફર ક્ષમતા ઓછી હોય છે), કોઈ પણ એસિડને પાણીના શરીરમાં ઉમેરવામાં આવે છે તેના pH ની ઊંચી એસિડિક મૂલ્યમાં.
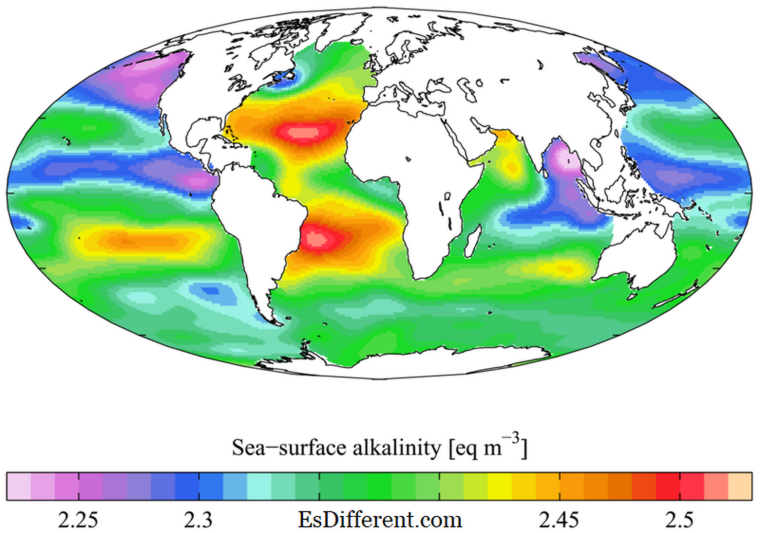
પાયાની મિલકત છે, પીએચ સ્કેલ માં માપી શકાય છે. પટ્ટાઓ એ 7 ઉપર પીએચ ધરાવતા સંયોજનો છે; પીએચ = 8 (ઓછા મૂળભૂત) થી pH = 18 (વધુ મૂળભૂત) થી. સંયોજનની મૂળભૂતતાને ત્રણ અલગ અલગ રીતે વ્યાખ્યાયિત કરી શકાય છે. એરહેનીયસ થિયરી મુજબ, પાયા તે પદાર્થો છે જે ઓએચ - આયનોનું ઉત્પાદન કરતા જલીય માધ્યમમાં વિભાજન કરે છે. બ્રંસ્ટેલ્ડ-લૌરી થિયરીમાં, પ્રોટોન સ્વીકારનારાઓને પાયા કહેવામાં આવે છે. લેવિસ થિયરી મુજબ, ઇલેક્ટ્રોન જોડી દાતાને બેઝ તરીકે ઓળખવામાં આવે છે. ઓએચ - આયનો, ઇટોનની દાન કરવાની ક્ષમતા સ્વીકારવાની ક્ષમતા અથવા ઇલેક્ટ્રોનને દાન કરવાની ક્ષમતાને મૂળભૂતતા એ મૂળભૂતતા છે.

આલ્કલીનટી અને બેનિસીટીમાં શું તફાવત છે?
આલ્કલાઇનિતા અને મૂળભૂતતાની વ્યાખ્યા:
અલ્કલીનિટી:
કેટલીક વ્યાખ્યાઓ ત્યાં છે. અલ્કલીનીટી એક લિટરના મિલિક્વેવેલન્સમાં માપવામાં આવેલા પાણીના નમૂનામાં દ્રાવકોની એસિડ તટસ્થ ક્ષમતા છે.
ટાઈટેરેટબલ કાર્બોનેટ અને નોનકોર્બોનેટ રાસાયણિક પ્રજાતિઓના ફિલ્ટર પાણીના નમૂનામાં.
એસિડ ઉકેલને બેઅસર કરવા માટે પાણીની ક્ષમતા.
જ્યારે એસિડ ઉમેરવામાં આવે ત્યારે તેના પી.એચ. મૂલ્યને બદલ્યા વિના, બાયોફરીંગ ક્ષમતા પાણીની સ્થિરતા જાળવી રાખવી.
મૂળભૂતતા:
ત્રણ સિદ્ધાંતોનો ઉપયોગ એસિડિટી અને લઘુમતીને વ્યાખ્યાયિત કરવા માટે કરવામાં આવે છે. અરેનિયિયસ:
પાયા એ પ્રજાતિઓ છે જે ઓએચ - પાણીમાં પેદા કરવા માટે આયોનાઇઝેશન છે. મૂળભૂત રીતે તે વધુ આયોનાઇઝેશન વધે છે, ઓએચ - પાણીમાં. બ્રોન્સ્ટડ-લૌરી:
પ્રોટોન (એચ + ) સ્વીકારનારાઓને પાયા કહેવાય છે લેવિસ:
ઇલેક્ટ્રોન જોડી દાતાઓને પાયા કહેવામાં આવે છે. અલ્કલીનિટી અને મૂળભૂતતાને અસર કરતાં પરિબળો:
અલ્કલીનિટી:
અલ્કલીનિટી પીએચ મૂલ્ય પર આધારિત નથી; જળાશયોમાં ક્યાં તો નીચલા (અત્યંત તેજાબી) અથવા ઊંચી (મૂળભૂત) પીએચ મૂલ્ય, આલ્કલાઇનની ઊંચી કિંમત સાથે હોઇ શકે છે. આલ્કલીનીટી ઘણા પરિબળો જેમ કે ખડકો, માટી, ક્ષાર અને અમુક ઔદ્યોગિક પ્રવૃત્તિઓ દ્વારા નક્કી થાય છે માણસ દ્વારા (પાણીમાં સાબુ અને ડિટર્જન્ટ ધરાવતી નકામી પાણી આલ્કલાઇન હોય છે). ઉદાહરણ તરીકે, જે વિસ્તારોમાં ચૂનો (CaCO 3 ) નોંધપાત્ર રીતે ઉપલબ્ધ છે તે વધુ આલ્કલાઇન પાણી હોઈ શકે છે. મૂળભૂતતા:
સંયોજનની મૂળભૂતતાની અસર કરતા પરિબળો મૂળિયાની વ્યાખ્યાના આધારે અલગ અલગ હોય છે. ઉદાહરણ તરીકે, આધારની ઇલેક્ટ્રોન જોડી ઉપલબ્ધતા ત્રણ પરિબળો પર આધાર રાખે છે. ઇલેક્ટ્રોનગેટિવિટી
: સીએચ 3-> NH2-> HO-> F- સામયિક કોષ્ટકમાં સમાન હરોળમાં પરમાણુ પર વિચાર કરતી વખતે, સૌથી વધુ ઇલેક્ટ્રોનેગેટિવ અણુમાં ઉચ્ચ મૂળભૂતતા હોય છે.
કદ
: એફ-> ક્લૉર-> બીઆર-> આઇ- સામયિક કોષ્ટકની હરોળ પર વિચાર કરતી વખતે મોટા પ્રમાણમાં અણુમાં ઓછું ઇલેક્ટ્રોન ઘનતા હોય છે અને તે ઓછું મૂળભૂત છે
રેઝોનન્સ
: આરઓ-> આરકો 2- વધુ પ્રતિધ્વનિ માળખા ધરાવતા અણુ ઓછા મૂળભૂત છે, કારણ કે સ્થાનિય નકારાત્મક ચાર્જ કરતાં ઓછી ઇલેક્ટ્રોન ઉપલબ્ધતા.
ચિત્ર સૌજન્ય:
1. પ્લુમ્બોગો દ્વારા "ડબલ્યુઓએ05 ગ્લોડપ પીએડએલકે એયુયુએલ" - પોતાના કામ [સીસી દ્વારા-એસએ 3. 0] કૉમન્સ મારફતે
2 અનામી દ્વારા "થોમસ માર્ટિન લોરી 2" - ફેરાડે સોક દ્વારા ઓબ્વિફ્યુરી. (1936) [જાહેર ડોમેન] કૉમન્સ દ્વારા




