1 સે અને 2 ઓ ઓર્બિટલ વચ્ચેના તફાવત. 1S vs 2s ઓર્બિટલ
કી તફાવત - 1s vs 2s ઓર્બિટલ
એટોમ બાબતનો સૌથી નાનો એકમ છે. બીજા શબ્દોમાં કહીએ તો, બધા પદાર્થ અણુથી બને છે. એક અણુ ઉપાટોમિક કણો, મુખ્યત્વે, પ્રોટોન, ઇલેક્ટ્રોન અને ન્યુટ્રોનથી બનેલો છે. પ્રોટોન અને ઇલેક્ટ્રોન એ ન્યુક્લિયસ બનાવે છે, જે અણુના કેન્દ્રમાં સ્થિત છે. પરંતુ ઇલેક્ટ્રોન ઓર્બિટલ્સ (અથવા ઉર્જા સ્તરો) માં સ્થિત થયેલ છે જે એક અણુના મધ્યભાગની બહાર સ્થિત છે. નોંધવું પણ મહત્વનું છે કે ઓર્બિટલ્સ કાલ્પનિક ખ્યાલો છે જે અણુના સંભવિત સ્થાનને સમજાવવા માટે વપરાય છે. બીજક આસપાસના વિવિધ ઓર્બિટેલ્સ છે. પેટા ઓર્બિટેલ્સ પણ છે જેમ કે એસ, પી, ડી, એફ, વગેરે. પેટા-ભ્રમણકક્ષા એ આકારમાં ગોળાકાર હોય છે જ્યારે તે 3D સ્ટ્રક્ચર તરીકે ગણવામાં આવે છે. ઓકેબીયમની આસપાસ ભ્રમણકક્ષામાં ઇલેક્ટ્રોન શોધવા માટેની સૌથી વધુ સંભાવના છે. સબ-ભ્રમણ કક્ષાનું ફરી 1 સે, 2 સે, 3 સે, વગેરે ઊર્જાનું સ્તર મુજબ ગણવામાં આવે છે. 1 સે અને 2 ઓ ઓર્બીટલ વચ્ચેના મુખ્ય તફાવત એ દરેક ઓર્બિટલની ઊર્જા છે. 1 ઓ ઓર્બીટલ પાસે 2 ઓ ઓર્બિટલ કરતાં નીચી ઊર્જા હોય છે.
વિષયવસ્તુ
1 ઝાંખી અને કી તફાવત
2 1 સે ઓર્બિટલ
3 શું છે 2s ઓર્બિટલ
4 શું છે સાઇડ બાય સાઇડરિસન - 1 સે વિ 2 સે ઓર્બિટલ
5 સારાંશ
1 સે ઓર્બિટલ શું છે?
1 ઓ ઓર્બિટલ એ ભ્રમણ કક્ષા છે કે જે મધ્યભાગની નજીક છે. અન્ય ઓર્બિટલ્સ વચ્ચે તેની સૌથી ઓછી ઊર્જા છે. તે પણ નાના ગોળાકાર આકાર છે. તેથી, ઓ ભ્રમણકક્ષાની ત્રિજ્યા નાની છે. ઓર્બીટલમાં ફક્ત 2 ઇલેક્ટ્રોન હોઈ શકે છે. ઇલેક્ટ્રોન કન્ફિગરેશનને 1 સે 1 તરીકે લખી શકાય છે, જો ઓ ઓર્બિટલમાં માત્ર એક જ ઇલેક્ટ્રોન છે. પરંતુ જો ઇલેક્ટ્રોનની જોડી હોય, તો તેને 1 સે 2 તરીકે લખી શકાય છે. ત્યારબાદ બે ઇલેક્ટ્રોન બે ભૌતિક ચળવળના કારણે બે ઇલેક્ટ્રોનના વિસર્જન માટે જવાબદાર છે. જયારે એક અનપેઇડેડ ઇલેક્ટ્રોન હોય છે ત્યારે તેને સર્વામેગ્નેટિક કહેવામાં આવે છે. તે એક ચુંબક દ્વારા આકર્ષાય છે કારણ કે તે છે. પરંતુ જો ભ્રમણકક્ષા ભરેલી હોય અને ઇલેક્ટ્રોનની એક જોડી હાજર હોય, તો ઇલેક્ટ્રોન ચુંબક દ્વારા આકર્ષિત કરી શકાતું નથી; આને ડાયગ્નેટિક તરીકે ઓળખવામાં આવે છે.
2 ઓ ઓર્બિટલ શું છે?
2 ઓ ઓર્બિટલ એ 1 ઓ ઓર્બિટલ કરતાં મોટી છે. તેથી, તેનું ત્રિજ્યા એ 1s ઓર્બિટલ કરતાં મોટી છે. 1 કે ઓર્બિટલ પછી તે બીજકમાં ભ્રમણ કક્ષા આગળની કબાટ છે. તેની ઊર્જા 1 ઓ ઓર્બિટલ કરતા વધારે છે પરંતુ અણુમાં અન્ય ઓર્બિટેલ્સ કરતા પણ ઓછી છે. 2 ઓ ઓર્બિટલ માત્ર એક અથવા બે ઇલેક્ટ્રોન સાથે ભરી શકાય છે. પરંતુ 2 ઓ ઓર્બિટલ ઇલેક્ટ્રોનથી ભરવામાં આવે છે.તેને ઔફબૌ સિદ્ધાંત કહેવામાં આવે છે, જે પેટા ઓર્બિટલ્સમાં ભરવા ઇલેક્ટ્રોનના ક્રમમાં સૂચવે છે.
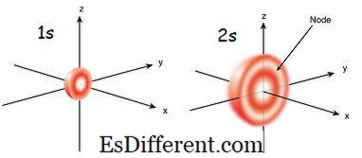
આકૃતિ 01: 1 સે અને 2 ઓ ઓર્બિટલ
1 સે અને 2 ઓ ઓર્બિટલ વચ્ચે શું તફાવત છે?
- કોષ્ટક પહેલાં વિભિન્ન કલમ મધ્ય ->
1 સે વિ 2 સે ઓર્બિટલ |
|
| 1 ઓ ઓર્બિટલ એ ન્યુક્લિયસ માટે સૌથી નજીકનું ભ્રમણ કક્ષ છે. | 2 ઓ ઓર્બીટલ એ ન્યુક્લિયસમાં બીજા ક્રમનું ઓર્બિટલ છે. |
| એનર્જી લેવલ | |
| 1 સે ઓર્બિટલની ઊર્જા 2 ઓ ઓર્બિટલ કરતાં વધારે છે. | 2 સેમાં તુલનાત્મક રીતે નીચી ઊર્જા છે |
| ઓર્બીટલના ત્રિજ્યા | |
| 1 સે ઓર્બિટલના ત્રિજ્યા નાની છે. | 2 ઓ ઓર્બીટલના ત્રિજ્યા પ્રમાણમાં મોટી છે. |
| ઓર્બીટલનું કદ | |
| 1 ઓ ઓર્બિટલમાં નાના ગોળાકાર આકાર હોય છે. | 2 ઓ ઓર્બિટલ એ 1 ઓ ઓર્બિટલ કરતાં મોટી છે. |
| ઇલેક્ટ્રોન ભરવા | |
| ઇલેક્ટ્રોન પ્રથમ 1 ઓ ઓર્બિટલમાં ભરવામાં આવે છે. | 2 ઓ ઓર્બિટલ માત્ર 1 ઓ ઓર્બિટલમાં ઇલેક્ટ્રોન પૂર્ણ કર્યા પછી ભરવામાં આવે છે. |
સારાંશ - 1 સે વિરુદ્ધ 2 ઓ ઓર્બીટલ
એક અણુ એ એક 3D સ્ટ્રક્ચર છે જે વિવિધ ઊર્જા સ્તરોના વિવિધ આકારોવાળા ઓર્બિટલ્સથી ઘેરાયેલા કેન્દ્રમાં કેન્દ્રિત છે. ઊર્જાના સહેજ તફાવત અનુસાર આ ઓર્બીટલ્સ ફરીથી સબ ઓર્બિટલ્સમાં વહેંચાયેલા છે. ઇલેક્ટ્રોન, જે એક અણુનું એક મુખ્ય સબાટોમિક કણો છે જે આ ઊર્જા સ્તરોમાં સ્થિત છે. 1 સે અને 2 સે પેટા-ઓર્બિટલ્સ ન્યુક્લિયસની નજીક છે. 1s અને 2s ઓર્બિટલ્સ વચ્ચેનો મુખ્ય તફાવત એ તેમના ઊર્જા સ્તરનો તફાવત છે, જે 2 ઓ ઓર્બિટલ એ 1 સે ઓર્બિટલ કરતાં ઊંચો ઊર્જા સ્તર છે.
સંદર્ભ:
1. લિબ્રેટેક્સ્ટ્સ "અણુ ઓર્બિટલ્સ" "કેમિસ્ટ્રી લિબ્રેટેક્સ. Libretexts, 03 નવે. 2015. વેબ 26 મે 2017.
2 અણુઓ, ઇલેક્ટ્રોન અને ઓર્બિટલ્સ એન. પી., n. ડી. વેબ 26 મે 2017.
ચિત્ર સૌજન્ય:
1. "એસ ઓર્બિટલ્સ" (પાક) સીકે -12 ફાઉન્ડેશન દ્વારા - ફાઇલ: હાઈ સ્કૂલ કેમિસ્ટ્રી પીડીએફ, પાનું 265 (સીસી દ્વારા-એસએ 3. 0) કોમન્સ દ્વારા વિકિમિડિયા



