આઇસોટોનિક અને હાયપરટોનિક વચ્ચેનો તફાવત | આઇસોટોનિક વિ હાયપરટોનિક
કી તફાવત - આઇસોટોનિક વિ હાયપરટોનિક
આઇસોટોનિક અને હાયપરટોનિક વચ્ચે તફાવતનું વિશ્લેષણ કરતાં પહેલાં ટોનિકસીટાની ખ્યાલને સમજવું અગત્યનું છે. તેથી, ચાલો પહેલા આપણે ટોનીસીટીની ખ્યાલ અને તેના મહત્વનું ટૂંકમાં વર્ણન કરીએ. સેમિપરેબલ પટલ દ્વારા વિભાજિત બે ઉકેલોની પાણીની સાંદ્રતામાં ટોનિકિસિટી એ તફાવત છે. તે ઉકેલોના સંબંધિત પાણીની સાંદ્રતા તરીકે પણ સમજાવી શકાય છે જે દિશા અને પાણીના પ્રસારની માત્રા નક્કી કરે છે જ્યાં સુધી તે કલાની બંને બાજુ પર સમાન સાંદ્રતા પ્રાપ્ત કરે નહીં. ઉકેલોની શક્તિને ઓળખીને, આપણે નક્કી કરી શકીએ છીએ કે કયા દિશામાં પાણી ફેલાય છે. બાહ્ય ઉકેલમાં ડૂબેલા કોશિકાઓના પ્રતિભાવને દર્શાવતી વખતે આ ઘટનાનો ઉપયોગ સામાન્ય રીતે થાય છે. ટોનીસિટીના ત્રણ વર્ગીકરણ છે કે એક ઉકેલ અન્ય સંબંધિત હોઈ શકે છે. તેઓ હાયપરટોનિક, હાઇપોટોનિક, અને આઇસોટોનિક છે. ઇસટોનિક અને હાયપરટોનિક વચ્ચેના કી તફાવત હાયપરટોનિક ઉકેલમાં સોલ્યુટ કરતાં વધુ દ્રાવક [999] જ્યારે સોલ્યુંટ અને દ્રાવક એસોયોનિક ઉકેલમાં સમાનરૂપે વિતરણ થાય છે. જોકે, હાયપરટોનિક અને આઇસોટોનિક સોલ્યુશન્સની વ્યાખ્યાને યાદ રાખવું આવશ્યક નથી જો આપણે એસોટોનિક અને હાયપરટોનિક ઉકેલો વચ્ચેનો તફાવત સમજી શકીએ.
હાઇપરન્ટિક શું છે?હાયપર ઉપર અથવા વધુ પડતા વધુ એક શબ્દ છે હાયપરટોનિક ઉકેલો સેલ કરતાં વધુ સોલ્યુશન (ગ્લુકોઝ અથવા મીઠું) નું વધારે પ્રમાણ ધરાવે છે. સોલ્યુટ્સ એ ઘટકો છે કે જે દ્રાવકમાં વિસર્જન થાય છે, ત્યાં ઉકેલ બનાવે છે. હાયપરટોનિક સોલ્યુશનમાં, સોલ્યુશન્સની સાંદ્રતા તેમાંથી અંદરની બહાર વધારે છે. જ્યારે કોષને હાયપરટોનિક ઉકેલમાં ડૂબી જાય છે ત્યારે એક ઓસ્મોટિક પાળી થશે અને પાણીના અણુઓ કોષમાંથી બહાર નીકળી જશે જેથી કોશિકાઓની સાંદ્રતાને સંતુલન કરવામાં આવે અને સેલના કદમાં સંકોચન થશે.
આઇસો એ સમાન માટેનો બીજો શબ્દ છે અને ટનિક ઉકેલની શક્તિ માટે છે. આઇસોટોનિક સોલ્યુશન્સની સરખામણી તેની સરખામણીમાં તેની સરખામણીમાં સોલ્યુશનની એક સમાનતા હશે. સમપ્રકાશીય ઉકેલમાં સેલ્યુલેર સંસ્થાના પર્યાવરણમાં સમલૈંગિકતાના નિર્માણમાં સેલ્સની અંદર અને બહાર બંને દ્રવ્યોનું પ્રમાણ સમાન છે. જ્યારે કોષને આઇસોટોનિક સોલ્યુશનમાં ડૂબી જાય છે, ત્યારે સોલ્યુશન્સની સાંદ્રતાને સંતુલિત કરવા માટે બંને દિશામાં કોશિકા કલા મારફતે અસ્મિકોટિક પાળી અને પાણીના અણુઓ ફેલાશે નહીં.આ પ્રક્રિયા સેલની સોજો અથવા સંકોચાઈ નાંખશે નહીં.

હાયપરટોનિક અને આઇસોટોનિક વચ્ચેનો તફાવત નીચેની શ્રેણીઓમાં વર્ગીકૃત કરી શકાય છે.
વ્યાખ્યા:
ઇસોટોનિક અને હાઇપરટોનિક હાઇપરટોનિક:
"હાયપર" એ ઉપર અથવા અતિશય તરીકે ઓળખાય છે + "ટોનિક" ઉકેલની રેખાઓ સાથે કંઈક તરીકે ઓળખાય છે. આમ, હાયપરટોનિક ઉકેલની વધતી શક્તિને સૂચવે છે આઇસોટોનિક:
"આઇસો" ને સમાન તરીકે ઓળખવામાં આવે છે + "ટોનિક" એ ઉકેલની રેખાઓ સાથે કંઈક તરીકે ઓળખાય છે. આમ, આઇસોટોનિક ઉકેલની સમાન તકનિકી સૂચવે છે લાક્ષણિકતાઓ
ઇસોટોનિક અને હાયપરટોનિક સોલ્યુશન અને ઉકેલનું એકાગ્રતા
હાઇપરટોનિક:
સોલ્યુશનમાં સોલ્યુંટ કરતાં વધુ દ્રાવક છે. ઇસોટોનિક:
ઉકેલમાં સોલ્યુટ અને દ્રાવક સમાન રીતે વહેંચવામાં આવે છે. ઉદાહરણો
હાઇપરટોનિક:
શુધ્ધ પાણી, કારણ કે શુદ્ધ પાણીમાં કોઈ / ઓછા સોલ્યુશન ઓગળી જાય છે, અને સેલ્યુલર પર્યાવરણની તુલનામાં તેની એકાગ્રતા ખૂબ નીચી છે. ઇસોટોનિક:
હાયપરટોનિક અને આઇસોટોનિક ઉકેલમાં સેલ્સ પ્રત્યુત્તર માનવ રક્ત પ્લાઝ્મા માટે એલોટ્યુનિક છે
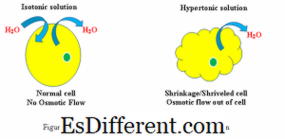
(આકૃતિ 1 જુઓ) હાઇપરન્ટિક:
જ્યારે એક જૈવિક સેલ એક હાયપરટોનિક પર્યાવરણ, કોશિકાના કોશિકામાંથી પાણી બહાર વહે છે, જેથી કોશિકાના કોશિકા અને પર્યાવરણ બંનેમાં દ્રાવ્યોની સાંદ્રતા સંતુલિત થાય. પરિણામે, કોષ ઘટાડે છે કારણ કે બાહ્ય પર્યાવરણમાં સોલ્યુશનની ઊંચી સાંદ્રતાને ઘટાડવા માટે પાણી સેલને છોડે છે. આઇસોટોનિક:
જ્યારે સેલ એસોયોટીક સોલ્યુશનમાં હોય, ત્યારે તે સેલની સોજો કે સંકોચાઈ નહીં કરે. પાણી એકાગ્રતા ઢાળ
હાઇપરટોનિક:
હાયપરટોનિક ઉકેલ માટે સેલની અંદરથી પાણીની એકાગ્રતાના ઢાળને જોઇ શકાય છે આઇસોટોનિક:
પાણી એકાગ્રતા ઢાળ અસ્તિત્વમાં નથી સોલ્યુટ એકાગ્રતા ઢાળ < હાઇપરટોનિક:
સોલ્યુટ એકાગ્રતા ઢાળ હાયપરટોનિક ઉકેલમાંથી સેલની અંદર દેખાય છે
આઇસોટોન: સોલ્યુટ કોન્સન્ટ્રેરેશન ગ્રેડેન્ટ અસ્તિત્વમાં નથી.
ઓસ્મોટિક પાળી હાઇપરટોનિક:
ઓસ્મોટિક પાળી અસ્તિત્વમાં છે.
આઇસોટોનિક: ઓસમીક પરિવર્તન અસ્તિત્વમાં નથી
પાણીનું ચળવળ હાયપરટોનિક:
પાણીના અણુઓ કોશિકાના અંદરના બાહ્ય ઉપાય દિશા નિર્દેશોથી ઝડપથી આગળ વધે છે અથવા ફેલાય છે, અને આમ સેલને પાણી ગુમાવશે.
આઇસોટોનિક: પાણીના અણુઓ બંને દિશામાં આગળ વધે છે અથવા પ્રસરે છે, અને પાણીના પ્રસારની દર દરેક દિશામાં સમાન છે. આમ સેલ કાં તો પાણી મેળવવા અથવા ગુમાવશે.
સ્પોર્ટ્સ પીણાં આઇસોટોનિક:
માનવ શરીરમાં મીઠા, ખાંડ કાર્બોહાઈડ્રેટ અને ઇલેક્ટ્રોલાઇટ્સ જેવી સમાન પ્રમાણમાં આઇસોટોનિક પીણું છે. આઇસોટોનિક સ્પોર્ટ્સ પીણું ઘણીવાર મૌખિક રીહાઈડરેશન સોલ્યુશન તરીકે પસંદ કરવામાં આવે છે. તે સામાન્ય રીતે 100 મિલિગ્રામ દીઠ 4-8 લિટર કાર્બોહાઇડ્રેટ હોય છે.
હાઇપરટોનિક: હાયપરટોનિક પીણુંમાં માનવ શરીરમાં મીઠું, ખાંડ કાર્બોહાઈડ્રેટ અને ઇલેક્ટ્રોલાઇટ્સનું પ્રમાણ વધારે હોય છે.તે સામાન્ય રીતે આશરે 8 ગ્રામ કાર્બોહાઇડ્રેટ દીઠ 100 મિલિગ્રામ હોય છે. મગજનો હેમરેજનું સંચાલન કરવા માટે હાયપરટોનિક ઉકેલનો ઉપયોગ ઓસ્મોથેરાપીમાં પણ થાય છે. હાયપરટોનિક સ્પોર્ટ્સ ડ્રીક્સ એવા લોકો માટે આદર્શ છે જેમને ઉર્જાના ઉચ્ચ સ્તરની જરૂર છે.
નિષ્કર્ષમાં, સોલ્યુશન્સનાં ત્રણ સ્વરૂપો છે જે સોલ્યુટ એકાગ્રતા પર આધારીત છે અને તેઓ ઇસોટોનિક, હાયપોટોનિક અને હાયપરટોનિક છે. સમયોની સાંદ્રતા એક સમાન સ્રોતમાં કોષની અંદર અને બહાર બંને છે. હાયપોટોનિક ઉકેલમાં બહારના વાતાવરણની સરખામણીમાં સેલ્સની સાંદ્રતા વધારે છે જ્યારે હાયપરટોનિક ઉકેલ એક છે જ્યાં કોશિકાઓની અંદરની અંદરની દ્રવ્યોનું પ્રમાણ વધારે છે. સંદર્ભો મનૂર, એમ. એ., બેવર્લી, જે., અને સેન્ડમેન (2002). એપ્લાઇડ ફિઝિકલ ફાર્મસી. મેકગ્રો-હિલ વ્યવસાયિક પાના 54-57 વેટ, ડી., જુડિથ, જી. વી. અને ચાર્લોટ, ડબ્લ્યુ. પી. (2001). ફૉન્ડામેન્ટલ્સ ઓફ બાયોકેમિસ્ટ્રી (રેવ. ઇડી.). ન્યૂ યોર્ક: વિલી પૃષ્ઠ 30. છબી સૌજન્ય: લેડિફહેટ્સ દ્વારા "બ્લડ કોશિકા રેખાકૃતિ પર ઓસ્મોટિક પ્રેશર" - તે મારી જાતે વિકિમીડીયા કૉમન્સ મારફતે [1], [2], [3] અને [4] … (જાહેર ડોમેન) પર આધારિત છે



