આયનીય અને સહસંયોજક સંયોજનો વચ્ચેનો તફાવત | આયનીય વિ કોવલન્ટ કંપાઉન્ડ
કી તફાવત - આયનીય વિ સહયોગ્ય સંયોજનો
આયૉનિક અને સહસંયોજક સંયોજનો વચ્ચેના ઘણાં તફાવતો તેમના મેક્રોસ્કોપિક ગુણધર્મો જેવા કે દ્રાવ્યતામાં પાણી, વિદ્યુત વાહકતા, ગલનબિંદુ અને ઉકળતા બિંદુઓ. આ તફાવતોનું મુખ્ય કારણ તેમની બંધન પેટર્નમાં તફાવત છે. તેથી, તેમના બંધન પેટર્ન ને આયનીય અને સહસંયોજક સંયોજનો વચ્ચેના મુખ્ય તફાવત તરીકે માનવામાં આવે છે. (આયોનિક અને સહસંયોજક બંધનો વચ્ચેનો તફાવત) જ્યારે આયનીય બોન્ડ્સ રચાય છે, ત્યારે ઇલેક્ટ્રોન (ધાતુ) દાન દ્વારા દાનમાં આપે છે અને દાન કરેલ ઇલેક્ટ્રોન (નો) એ બિન-મેટલ દ્વારા સ્વીકારવામાં આવે છે. ઇલેકટ્રોસ્ટેટિક આકર્ષણના કારણે તેઓ મજબૂત બોન્ડ બનાવે છે. સહ-નિર્ધારિત બોન્ડ બે બિન-ધાતુ વચ્ચે રચાય છે સહસંયોજક જોડાણમાં, ઓક્ટેટ નિયમને સંતોષવા બે અથવા વધુ પરમાણુઓ ઇલેક્ટ્રોન વહેંચે છે. સામાન્યપણે, સહિયારી બોન્ડ્સ કરતાં આયનીય બોન્ડ મજબૂત છે. આ તેમના ભૌતિક ગુણધર્મોમાં તફાવતો તરફ દોરી જાય છે.
આયોનિક કંપાઉન્ડ શું છે?બે અણુઓ તેમના ઇલેક્ટ્રોનેટીટી વેલ્યુમાં મોટો ફરક ધરાવે છે ત્યારે આયોનિક બોન્ડ રચાય છે. બોન્ડ રચનાની પ્રક્રિયામાં, ઇલેક્ટ્રોનગેટિવ ઇલેક્ટ્રોનગેટિવ એટોમ ઇલેક્ટ્રોન (ઓ) અને વધુ ઇલેક્ટ્રોનેગેટિવ એટોમ તે ઇલેક્ટ્રોન (ઓ) ને ફાયદાકારક બનાવે છે. પરિણામે, પરિણામી પ્રજાતિઓ આંશિક રૂપે આયનોને ચાર્જ કરે છે અને મજબૂત ઇલેકટ્રોસ્ટેટિક આકર્ષણને કારણે તેઓ બોન્ડ બનાવે છે.
ionic સંયોજનનું ઉદાહરણ
ના + + સીએલ - નૅકલ સોડિયમ (ધાતુ) પાસે માત્ર એક વાલ્ડેન્સ ઇલેક્ટ્રોન અને ક્લોરિન (બિન-મેટલ) છે સાત વેલેન્સ ઇલેક્ટ્રોન

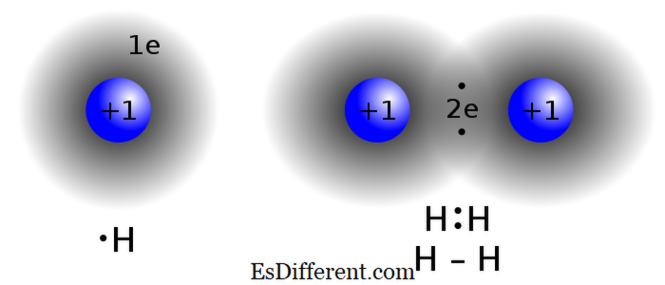
"ઓક્ટેટ શાસન" ને સંતોષવા માટે બે અથવા વધુ અણુ વચ્ચે ઇલેક્ટ્રોન વહેંચીને સહસંબંધિક સંયોજનો રચાય છે. આ બંધન પ્રકાર સામાન્ય રીતે બિન-મેટલ સંયોજનો, સામયિક કોષ્ટકમાં સમાન સંયોજન અથવા નજીકના ઘટકોના અણુમાં જોવા મળે છે. લગભગ સમાન ઇલેક્ટ્રોનગેટિવ વેલ્યુ ધરાવતા બે અણુ તેમના વાલ્ડેન્સ શેલમાંથી (દાન / પ્રાપ્ત કરો) ઇલેક્ટ્રોન નથી. તેના બદલે, તેઓ ઓક્ટેટ રૂપરેખાંકન હાંસલ કરવા માટે ઇલેક્ટ્રોન શેર કરે છે.
સહસંયોજક સંયોજનોના ઉદાહરણો
મિથેન (સીએચ 4 ), કાર્બન મોનોક્સાઇડ (CO), આયોડિન મોનોબોમાઇડ (આઈબીઆર) સહસંયોજક બંધન
આયોનિક અને સહસંયોજક વચ્ચે શું તફાવત છે સંયોજનો?
આયોનિક સંયોજનો અને સહસંયોજક સંયોજનોની વ્યાખ્યા
આયોનિક સંયોજન:
આયોનિક સંયોજનો એક રાસાયણિક સંયોજનો છે, જે આયન અને આયનનો સમાવેશ થાય છે, જે જાળીના માળખામાં ઇઓનિક બોન્ડ દ્વારા એકસાથે રાખવામાં આવે છે. સહસંયોજક સંયોજન:
સહસંયોજક સંયોજન અણુઓ વચ્ચે એક કે તેથી વધુ ઇલેક્ટ્રોન, ખાસ કરીને ઇલેક્ટ્રોનની જોડી, દ્વારા વહેંચણી દ્વારા રચાયેલી રાસાયણિક બોન્ડ છે. આયનિક અને સહસંયોજક સંયોજનોની ગુણધર્મો
ભૌતિક ગુણધર્મો
આયનીય સંયોજનો:
બધા આયનીય સંયોજનો ઓરડાના તાપમાને ઘન પદાર્થ તરીકે અસ્તિત્વ ધરાવે છે.
આયોનિક કંપાઉન્ડમાં સ્થિર સ્ફટિકનું માળખું છે. તેથી, તેઓ વધુ ગલનબિંદુ અને ઉકળતા બિંદુઓ ધરાવે છે. હકારાત્મક અને નકારાત્મક આયનો વચ્ચે આકર્ષણની પરિબળો ખૂબ મજબૂત છે.
ટેબલ ->
આયોનિક કંપાઉન્ડ| દેખાવ | મેલ્ટિંગ પોઇન્ટ | NaCl - સોડિયમ ક્લોરાઇડ |
| સફેદ સ્ફટિકીય ઘન | 801 ° સે | કેએલસી - પોટેશિયમ ક્લોરાઇડ |
| સફેદ અથવા રંગહીન કાટખૂણે સ્ફટિક | 770 ° સે | એમજીએમએલ |
| 2 - મેગ્નેશિયમ ક્લોરાઇડ સફેદ અથવા રંગહીન સ્ફટિકીય ઘન | 1412 ° સે | સહસંયોજક સંયોજનો: તમામ ત્રણ સ્વરૂપોમાં સહસંયોજક સંયોજનો અસ્તિત્વ ધરાવે છે; ઓરડાના તાપમાને ઘન, પ્રવાહી અને વાયુઓ તરીકે. |
આયર્ન સંયોજનોની સરખામણીમાં તેમના ગલન અને ઉકળતા પોઇન્ટ પ્રમાણમાં ઓછી છે.
સહસંયોજક કમ્પાઉન્ડ
દેખાવ
| મેલ્ટિંગ પોઇન્ટ | એચસીએલ-હાઇડ્રોજન ક્લોરાઇડ | રંગહીન ગેસ |
| -114 2 ° સે | સીએચ | 4 |
| -મેથેન એક રંગહીન ગેસ -182 ° સે | સીસીએલ | 4 |
| - કાર્બન ટેટ્રાક્લોરાઇડ રંગહીન પ્રવાહી < -23 ° સે સંયુકતતા | આયનીય સંયોજનો: | સોલિડ ઇઓનિક સંયોજનોમાં મુક્ત ઇલેક્ટ્રોન નથી; તેથી તેઓ સખત સ્વરૂપમાં વીજ લઈ શકતા નથી. પરંતુ, જ્યારે આયનીય સંયોજનો પાણીમાં વિસર્જન થાય છે ત્યારે તેઓ એક ઉકેલ કરે છે જે વીજળીનું સંચાલન કરે છે. અન્ય શબ્દોમાં, આયનીય સંયોજનોના જલીય ઉકેલો સારી વિદ્યુત વાહક છે. |
સહસંયોજક સંયોજનો:
નહી શુદ્ધ સહસંયોજક સંયોજનો અથવા પાણીમાં ઓગળેલા સ્વરૂપો વીજળીનું સંચાલન કરતા નથી. તેથી, સહસંયોજક સંયોજનો બધા તબક્કાઓમાં નબળા વિદ્યુત વાહક છે. સોલ્યુબિલિટી
આયનીય સંયોજનો: મોટા ભાગના આયનીય સંયોજનો પાણીમાં દ્રાવ્ય છે, પરંતુ તે બિન-ધ્રુવીય દ્રાવકોમાં અદ્રાવ્ય છે.
સહસંયોજક સંયોજનો:
મોટાભાગના સહસંયોજક સંયોજનો બિન-ધ્રુવીય દ્રાવકોમાં દ્રાવ્ય છે, પરંતુ પાણીમાં નહીં. કઠિનતા
આયનીય સંયોજનો: આયનીય ઘન કઠણ અને બરડ સંયોજનો છે.
સહસંયોજક સંયોજનો:
સામાન્ય રીતે, સહસંયોજક સંયોજનો ionic ઘનતા કરતાં નરમ હોય છે. છબી સૌજન્ય: જેએસક એફએચ દ્વારા "કોovalન્ટ બોન્ડ હાઇડ્રોજન" - પોતાના કામ. (સીસી દ્વારા-એસએ 3. 0) રેનશોટ દ્વારા કૉમન્સ "આઇઓનિકબૉન્ડીંગ આરએચ 11" - પોતાના કામ (સીસી દ્વારા-એસએ 3. 0) વિકિમિડિયા કૉમન્સ દ્વારા


